
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
分析 短周期元素中,A、D均有最低价-2,处于ⅥA族,且A有最高价+6,且氢化物沸点A<D,故A为S元素、D为O元素;C、H均有+4、-4价,处于ⅣA族,氢化物沸点C>H,故C为Si、H为碳元素;B、E均有+5、-3价,处于VA族,氢化物沸点B>E,故B为N元素、E为P元素;F、G均有-1价,处于ⅦA族,且G有+7价,氢化物沸点F>G,故F为F元素、G为Cl,据此解答.
解答 解:短周期元素中,A、D均有最低价-2,处于ⅥA族,且A有最高价+6,且氢化物沸点A<D,故A为S元素、D为O元素;C、H均有+4、-4价,处于ⅣA族,氢化物沸点C>H,故C为Si、H为碳元素;B、E均有+5、-3价,处于VA族,氢化物沸点B>E,故B为N元素、E为P元素;F、G均有-1价,处于ⅦA族,且G有+7价,氢化物沸点F>G,故F为F元素、G为Cl.
(1)S、Si、P、Cl属于第三周期元素,H的最高价氧化物为CO2,结构式:O=C=O
故答案为:ACEG;O=C=O;
(2)A、D、G三种简单阴离子分别为S2-、O2-、Cl-,电子层结构相同的离子,核电荷数越多离子半径越小,离子电子层越多,离子半径越大,故离子半径:r(S2-)>r(Cl-)>r(O2-);
F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高,
故答案为:r(S2-)>r(Cl-)>r(O2-);F、G形成的氢化物分别为HF、HCl,两者形成的晶体都为分子晶体,而HF分子之间易形成氢键,所以沸点HF的高;
(3)由表中O元素和氢元素的原子按1:1组成的常见液态化合物为H2O2,H2O2具有强氧化性、还原性,可以氧化Na2SO3,能被KMnO4氧化,H2O2的稀溶液易被MnO2、FeCl3 催化分解,
故答案为:ab;
(4)SOCl2在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸,则生成SO2与HCl,该反应的化学方程式是SOCl2+H2O=SO2↑+2HCl,
故答案为:SOCl2+H2O=SO2↑+2HCl;
(5)a.由于键长Si-Si键>C-C键,故C-C键更稳定性,则晶体硅的沸点低于金刚石,氢化物均为分子晶体,SiH4的相对分子质量大于CH4的,SiH4分子之间作用力更强,沸点更高,二氧化硅属于原子晶体,二氧化碳属于分子晶体,故二氧化硅的沸点更高,故a错误;
b.工业上利用焦炭与二氧化硅反应得到粗硅,再利用硅与氯气发生反应生成四氯化硅、四氯化硅被氢气还原得到硅,进行粗硅的提纯;Si可以与强碱、氢氟酸,故b正确;
c.把氧气通入到硫化氢的水溶液中反应生成S与水,可以说明氧元素非金属性比硫的强,故c正确,
故选:bc.
点评 本题考查性质结构位置关系应用,关键是利用化合价、氢化物沸点推断元素,注意对基础知识的理解掌握.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:选择题
| A. | NaNO2既具有氧化性又具有还原性 | |
| B. | 食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害 | |
| C. | NaNO2和胃酸作用的离子方程式为:2NO2-+2H+═NO↑+NO2↑+H2O | |
| D. | 1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 上述反应中,△H<0 | |
| B. | c点时,消耗Y和W的速率相等 | |
| C. | 正反应速率:a<b | |
| D. | ac段,升高温度,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
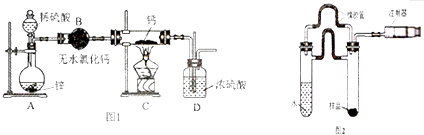
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
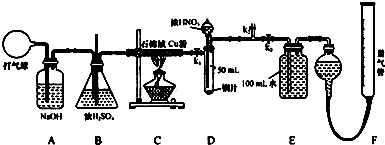
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
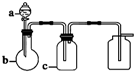 表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是( )
表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是( )| 选项 | 气体 | a | b | c |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | CO2 | 70%浓H2SO4 | Na2SO3固体 | 95%浓H2SO4 |
| C | NO | 稀硝酸 | 铜屑 | H2O |
| D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 探究温度对反应速率影响时,应先分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度后再混合,不是先将两种溶液混合后再用水浴加热 | |
| B. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| C. | 使用含有氯化钠的融雪剂会加快铁桥梁的腐蚀 | |
| D. | 判断皂化反应是否完全,可取反应后的混合液滴入热水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com