
【题目】已知某密闭容器中存在可逆反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g) ΔH。测得其他条件相同时,CO的平衡转化率随着温度(T)、压强(p)的变化如图1中曲线所示, 平衡常数K与温度关系如图2所示。
回答下列问题:
图1 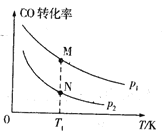 图2
图2 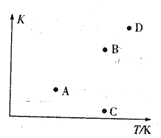
(1)该反应的ΔH___0(填“>”或“<”,后同),pl____p2,M、N相比,混合气体平均相对分子质量较大的是____。
(2) A、B, C、D四点中能正确表示该反应的平衡常数与温度T的关系的点为_____。
(3)下列各项数据能表明一定温度下,恒容密闭容器中反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)达到平衡状态的是___。
a.气体密度保持不变 b.反应过程中 c(CO):c(H2)=1:2
c.生成速率:v(CO)=2v(H2O) d. ΔH—定
(4)若在恒容条件下,最初向容器中通入1 mol CO、2 mol H2,在适当催化剂、温度下使其发生反应2CO(g)+4H2(g) =CH3CH2OH(g)+H2O(g)。测得开始时容器总压为 3xl05Pa,反应经2 min达到平衡且平衡时体系压强降低了![]() ,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
,则v(CO)= ____Pa/min,该温度下的平衡常数为Kp的值为____。
【答案】< > M AC c 2.5×104 2.5×10-21Pa-4
【解析】
(1)由M=![]() 知混合气体总物质的量越小,平均摩尔质量越大,即M点平均摩尔质量较大;
知混合气体总物质的量越小,平均摩尔质量越大,即M点平均摩尔质量较大;
(2)因为温度越高,平衡常数越小;
(3)根据变量不变达平衡进行判断;
(4) 利用三段式进行分析计算。
(1)由图知,其他条件相同时,温度越高CO的平衡转化率越低,说明正反应是放热反应,故△H<0;正反应是气体分子数目减小的反应,故压强越大转化率越大,p1>p2;CO转化率越大,混合气体总物质的量越小,由M=![]() 知平均摩尔质量越大,即M点平均摩尔质量较大;
知平均摩尔质量越大,即M点平均摩尔质量较大;
(2)因为温度越高,平衡常数越小,故符合条件的是A、C (注意从整体上看B、D点均不正确)。
(3)a、由方程式知,气体总质量恒定,容器容积恒定,故密度是个定值,选项a错误;
b、反应过程中a(CO):c(H2)=1:2,取决于反应物充入量,不能判断化学反应是否达到平衡状态,选项b错误;
c、生成2x mol的CO的同时生成x mol的H2O,说明反应达到平衡,选项c正确;
d、对于一个确定的反应方程式来说,△H保持不变,选项d错误。
答案选c;
(4) 2CO(g)+4H2(g)=CH3CH2OH(g)+H2O(g)
开始物质的量(mol) 1 2 0 0
变化物质的量(mol) x 2x 0.5x 0.5x
平衡物质的量(mol) 1-x 2-2x 0.5x 0.5x
(1+2):(3-2x)=3×105 : (3×105×![]() ),x=0.5;
),x=0.5;
开始时p(CO)=![]() ×3×105Pa=1×105Pa,
×3×105Pa=1×105Pa,
平衡时p(CO)=![]() ×3×105×
×3×105×![]() Pa=5×104Pa,故v(CO)=2.5×104Pa/min。
Pa=5×104Pa,故v(CO)=2.5×104Pa/min。
p(H2)= 1×105Pa,p(CH3CH2OH)=p(H2O)=![]() ×3×105×
×3×105×![]() Pa =2.5×104Pa,Kp=2.5×10-21Pa-4。
Pa =2.5×104Pa,Kp=2.5×10-21Pa-4。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】短周期元素中:A是地壳中含量最高的元素;B比Ne的质子数多1个;C最外层电子数与其电子层数相等;D单质是半导体材料;E非金属性在同周期元素中最强。下列说法中正确的是
A. B离子的半径比C离子的半径小
B. C单质与A或E单质形成的化合物均为离子化合物
C. A、B两单质反应可得到两种不同的离子化合物
D. B最高价氧化物对应的水化物与0.1mol D单质充分反应放出4.48L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构如表所示:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:______。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填字母)。
A.Y单质的熔点比Z单质低
B.Y的化合价比Z低
C.Y单质与水反应比Z单质与水反应剧烈
D.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:______。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)______r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用一定量铜片和50 mL浓度为2.0 mol/L的硝酸反应,当铜片完全溶解时收集到标准状况下280 mL的一氧化氮。请回答(忽略溶液体积变化):
(1)反应后溶液呈_______性(用“酸”、“碱”或“中”填空);
(2)反应后溶液中铜离子的物质的量浓度是多少_______(写出计算过程,保留三位有效数字)?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是( )
A.在含![]() 个硅原子的二氧化硅晶体中含有
个硅原子的二氧化硅晶体中含有![]() 个
个![]() 键
键
B.![]() 与
与![]() 的分子结构都是正四面体形,因此在
的分子结构都是正四面体形,因此在![]() 个
个![]() 分子或
分子或![]() 分子中都含有
分子中都含有![]() 个共价键
个共价键
C.5.6g![]() 与含0.2mol
与含0.2mol![]() 的溶液充分反应,至少失去
的溶液充分反应,至少失去![]() 个电子
个电子
D.![]() 个
个![]() 完全水解可以得到
完全水解可以得到![]() 个氢氧化铁胶体
个氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制0.2mol/L的CuSO4溶液98mL,并探究硫酸铜的性质。实验室有两种不同的试剂可供选用:① CuSO4·5H2O晶体;②16%的CuSO4溶液 (ρ=2.3 g/mL)。回答下列问题:
(1)配制该硫酸铜溶液应选用的玻璃仪器除量筒、烧杯和玻璃棒外,还有________。
(2)若取用①来配置该硫酸铜溶液,需用托盘天平称量_______g;若取用②来配置,所选用硫酸铜溶液的体积为_______mL。
(3)若取用②来配置,下列操作会使得所配硫酸铜溶液浓度偏低的是____(填编号)。
a.量取硫酸铜溶液的量筒未用蒸馏水洗涤 b.容量瓶中有少量水
c.定容摇匀时,液面下降又加水 d.定容时仰视刻度线
(4)取所配硫酸铜溶液,往其中加入BaCl2溶液,观察有白色沉淀出现。如何证明所取溶液中的硫酸根离子沉淀完全?________。
(5)课堂上,老师演示了金属钠与CuSO4溶液反应的实验,大家都观察到有蓝色沉淀生成,用化学反应方程式解释原因_________。个别较细心的同学还发现生成的蓝色沉淀中混有少量黑色难溶物,而所使用的药品均没有问题,该黑色难溶物是________(填化学式),猜测生成该黑色难溶物的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“生活无处不化学”,回答下列问题:
(1)用白醋浸泡开水壶,第二天发现壶内水垢消失,开水壶又光洁如新了(水垢的主要成分是碳酸钙等)。该离子反应方程式为____________。
(2)食盐不慎洒落在天然气的火焰上,观察到的现象是_____,该变化称为_____反应。
(3)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是____________。
(4)面包在制作时会加入小苏打,利用其加热产生气体的性质,可将小苏打作为膨松剂,该反应的化学方程式是________________。
(5)光导纤维、沙子、石英和玛瑙的主要成分是__________(填化学式)。
(6)赏心悦目的雕花玻璃是用__________(填名称)对玻璃进行刻蚀而制成的。
(7)使用“84”消毒液(含NaClO)时,按一定比例将它与水混合,并在空气中浸泡一段时间,使NaClO与H2O及空气中的CO2充分反应,以达到杀菌消毒的效果更好的目的。将该反应的离子方程式补充完整:![]() ____+____。
____+____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应,xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,在达到平衡时,测得A的浓度降低为0.30mol/L。下列说法正确的是( )
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,在达到平衡时,测得A的浓度降低为0.30mol/L。下列说法正确的是( )
A. 平衡向正反应方向移动 B. C的体积分数下降 C. B的转化率升高 D. x+y<z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃,101kpa下由甲醛蒸气(HCHO),H2和CO组成的混合气体共6.72g,其相对H2的密度为14.将该气体与2.24LO2(标况下)充分反应后的产物通过足量的Na2O2粉末,Na2O2粉末增重的质量( )
A.<6.72gB.=6.72gC.>6.72gD.无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com