
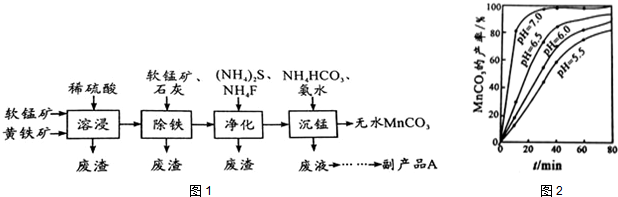
分析 由流程可知软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸过滤得到浸出液调节溶液pH,FeS2和稀硫酸反应生成Fe2+,然后过滤得到滤渣是MnO2,向滤液中加入软锰矿发生的离子反应方程式为:2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42,过滤,滤液中主要含有Cu2+、Ca2+等杂质,加入硫化铵和氟化铵,除去Cu2+、Ca2+过滤,在滤液中加入碳酸氢铵和氨水沉锰,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,通过洗涤、烘干得到MnCO3晶体.
(1)根据Ksp(CaF2)和c(F-),写出溶度积常数表达式求算钙离子浓度;
(2)根据沉锰的图象可知,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果;
(3)从沉锰工序中得到纯净MnCO3,只需将沉淀析出的MnCO3过滤、洗涤、干燥即可得到碳酸锰;
(4)n(C2O42-)=2.68g÷134g/mol=0.02mol;滴定250mL稀释后溶液,消耗n(MnO4-)=0.0200mol/L×0.0200L×10=0.00400mol;根据氧化还原反应中得失电子数相等得n(MnO2)×2+0.00400mol×5=0.0200mol×2,n(MnO2)=0.0100mol,再根据质量分数公式计算其质量分数.
解答 解:(1)由于第二步加入了石灰引入了钙离子,需除去溶液中的铜离子和钙离子,需分别加入硫化铵、氟化铵,已知Ksp(CaF2))=1.46×10-10,c(F-)=0.01 mol•L-1 ,则c(Ca2+)=$\frac{{K}_{sp}}{{C}^{2}({F}^{-})}$=$\frac{1.46×1{0}^{-10}}{0.0{1}^{2}}$mol/L=1.46×10-6mol•L-1,
故答案为:1.46×10-6 mol/L;
(2)从沉锰的图象可以看出,在已给的几个pH值条件下,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果,因此结论是pH等于7.0时反应速率最快,且MnCO3的产率最高,
故答案为:pH等于7.0时反应速率最快,且MnCO3的产率最高(或pH越大得到的MnCO3的产率越高,所需要的时间越短,且在pH=7时,有更好的效果);
(3)因为MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解,因此从沉锰工序中得到纯净MnCO3,因此从沉锰工序中得到纯净MnCO3的操作方法是:过滤、先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥),用水洗去可溶性杂质,用乙醇洗去水分,低温干燥防止碳酸锰分解,
故答案为:先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥);
(4)n(C2O42-)=2.68g÷134g/mol=0.02mol;滴定250mL稀释后溶液,消耗n(MnO4-)=0.0200mol/L×0.0200L×10=0.00400mol;
根据氧化还原反应中得失电子数相等得n(MnO2)×2+0.00400mol×5=0.0200mol×2,n(MnO2)=0.0100mol,
二氧化锰质量分数=$\frac{0.0100mol×87g/mol}{1.20g}$×100%=72.5%,
故答案为:72.5%.
点评 本题考查物质制备,为高频考点,涉及方程式的计算、溶度积常数计算、物质分离和提纯操作、图象分析等知识点,侧重考查学生分析、计算能力,难点是(4)题计算,注意转移电子守恒的应用.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023是阿伏加德罗常数的近似值 | |
| B. | 阿伏加德常数个微粒的物质的量是1 mol | |
| C. | 1 mol 12C原子的质量为12 g | |
| D. | 硫酸的摩尔质量是98 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
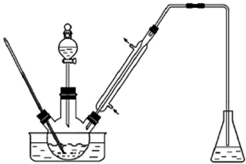 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
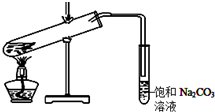 某学生做乙酸乙酯的制备实验装置如图所示.
某学生做乙酸乙酯的制备实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室将硫酸铜溶液直接加热蒸干来制取CuSO4•5H2O | |
| B. | 用湿润的pH试纸来测溶液的pH | |
| C. | 不慎将浓碱溶液沾到皮肤上,可先立即用稀盐酸中和,后用大量水冲洗,再涂上2%~5%的硼酸溶液 | |
| D. | 用四氯化碳萃取溴水中的溴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com