【答案】
分析:(1)依据盖斯定律结合题干热化学方程式计算得到;
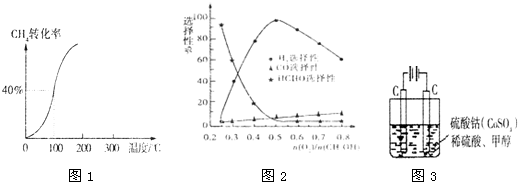
(2)①100°时甲烷的转化率为40%,变化的甲烷为0.4mol,生成的氢气依据反应①CH
4(g)+H
2O(g)=CO(g)+3H
2(g)△H=+206.0kJ/mol;可知氢气物质的量为1.2mol,依据反应速率概念计算;
②依据化学平衡三段式计算平衡浓度、根据平衡常数的概念计算得到;
(3)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH
2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H
2(g)=CH
3OH(g)△H=-129.0kJ/mol;
平衡后将容器的容积压缩到原来的

,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行;
(4)①反应为CH
3OH(g)?CO(g)+2H
2(g),此反应能自发进行的原因是△H-T△S<0,反应是熵增加的反应;
②当n(O
2)/n(CH
3OH)=0.25时,CH
3OH与O
2发生的主要反应为甲醇的催化氧化生成甲醛,反应的方程式为:2CH
3OH+O
2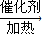
2HCHO+2H
2O;
(5)①通电后,将Co
2+氧化成Co
3+,电解池中阳极失电子发生氧化反应,电极反应为Co
2+-e
-=Co
3+;
②以Co
3+做氧化剂把水中的甲醇氧化成CO
2而净化的离子方程式结合氧化还原反应的实质原子守恒,电荷守恒配平书写为:6Co
3++CH
3OH+H
2O=CO
2↑+6Co
2++6H
+;
解答:解:(1)依据盖斯定律结合题干热化学方程式计算得到;①CH
4(g)+H
2O(g)=CO(g)+3H
2(g)△H=+206.0kJ/mol;②CO(g)+2H
2(g)=CH
3OH(g)△H=-129.0kJ/mol
①-②得到CH
4(g)与H
2O(g)反应生成CH
3OH(g)和H
2(g)的热化学方程式为:CH
4(g)+H
2O(g)=CH
3OH(g)+H
2(g)△H=+77.0KJ/L;
故答案为:CH
4(g)+H
2O(g)=CH
3OH(g)+H
2(g)△H=+77.0KJ/L
(2)①100°时甲烷的转化率为40%,变化的甲烷为0.4mol,生成的氢气依据反应①CH
4(g)+H
2O(g)=CO(g)+3H
2(g)△H=+206.0kJ/mol;可知氢气物质的量为1.2mol,用H
2表示该反应的平均反应速率=
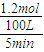
=0.0024mol/L?min;
②依据化学平衡三段式计算平衡浓度、根据平衡常数的概念计算得到
CH
4(g)+H
2O(g)=CO(g)+3H
2(g)
起始量(mol/L)0.01 0.02 0 0
变化量(mol/L) 0.004 0.004 0.004 0.012
平衡量(mol/L)0.006 0.016 0.004 0.012
K=

=
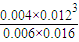
=7.2×10
-5(mol/L)
2故答案为:0.0024mol/L?min;7.2×10
-5(mol/L)
2(3)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH
2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H
2(g)=CH
3OH(g)△H=-129.0kJ/mol;
平衡后将容器的容积压缩到原来的

,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行
A、体积减小,c(H
2)增大,故A错误;
B、压强增大,正逆反应速率都加快,故B错误;
C、体积减小,压强增大,平衡正向进行,CH
3OH的物质的量增加,故C正确;
D、体积减小,压强增大,平衡正向进行,重新平衡时
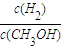
减小,故D正确;
E、平衡常数K只随温度的而变化,故E错误;
故选CD;
(4)①反应为CH
3OH(g)?CO(g)+2H
2(g),此反应能自发进行的原因是△H-T△S<0,反应是熵增加的反应,;
②当n(O
2)/n(CH
3OH)=0.25时,CH
3OH与O
2发生的主要反应为甲醇的催化氧化生成甲醛,反应的方程式为:2CH
3OH+O
2
2HCHO+2H
2O;
故答案为:反应是熵增加的反应;2CH
3OH+O
2
2HCHO+2H
2O
(5)①通电后,将Co
2+氧化成Co
3+,电解池中阳极失电子发生氧化反应,电极反应为Co
2+-e
-=Co
3+;
②以Co
3+做氧化剂把水中的甲醇氧化成CO
2而净化的离子方程式结合氧化还原反应的实质原子守恒,电荷守恒配平书写为:6Co
3++CH
3OH+H
2O=CO
2↑+6Co
2++6H
+;
故答案为:Co
2+-e
-=Co
3+;6Co
3++CH
3OH+H
2O=CO
2↑+6Co
2++6H
+;
点评:本题考查了热化学方程式的书写,盖斯定律的应用,原电池和电解池原理的综合应用,化学平衡的影响因素分析,反应速率的计算,离子方程式的书写,题目综合性大,难度中等.

 ,其他条件不变,对平衡体系产生的影响是______(填字母序号).
,其他条件不变,对平衡体系产生的影响是______(填字母序号).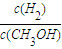 减小 E.平衡常数K增大
减小 E.平衡常数K增大 ,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行;
,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行; 2HCHO+2H2O;
2HCHO+2H2O;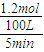 =0.0024mol/L?min;
=0.0024mol/L?min; =
=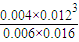 =7.2×10-5(mol/L)2
=7.2×10-5(mol/L)2 ,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行
,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行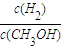 减小,故D正确;
减小,故D正确; 2HCHO+2H2O;
2HCHO+2H2O; 2HCHO+2H2O
2HCHO+2H2O

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案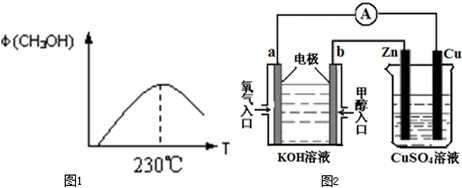
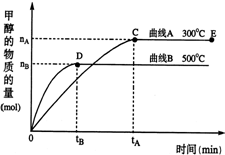 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)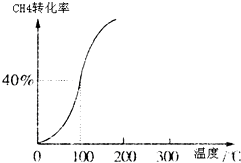 Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
Ⅰ、合成氨对农业生产及国防建设均具有重要意义.