
| A、质量分数约为26.7% |
| B、物质的量浓度为100mol/L |
| C、因缺少数据质量分数无法计算 |
| D、因缺少数据物质的量浓度无法计算 |
| V |
| Vm |
| m(溶质) |
| m(溶液) |
| 22.4L |
| 22.4L/mol |
| 36.5g |
| 136.5g |


科目:高中化学 来源: 题型:
| A、乙烯使KMnO4溶液褪色 |
| B、乙烯使溴的四氯化碳溶液褪色 |
| C、甲烷和氯气混合,见光 |
| D、用乙醇、乙酸与浓H2SO4混合加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据某元素的原子结构示意图判断该元素原子核中有几个中子 |
| B、根据密度数据判断液体物质挥发性的大小 |
| C、根据“各种物质在不同温度时的溶解度表”,设计通过蒸发、结晶把混合溶液中某些物质分离出来的方法 |
| D、根据“相对原子质量表”判断每种元素原子中的质子数、中子数和核外电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应中铁元素被氧化,硫元素被还原 |
| B、该反应中每消耗3molFe2+,3molFe2+失去3mol电子 |
| C、该反应中转移电子总数为4e- |
| D、Fe2+、S2O32-在碱性条件下能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g 镁作还原剂时失去电子数是0.1×6.02×1023 |
| B、标准状况下,22.4L 氮气中含有的共价键数是6.02×1023 |
| C、标准状况下,5.6 L的甲醛所含的电子数是4×6.02×1023 |
| D、100mL 1mol/L氨水溶液中,铵根离子的个数0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
| ||||
| B、用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | ||||
C、实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-
| ||||
| D、用FeCl3溶液腐蚀印刷铜电路板:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
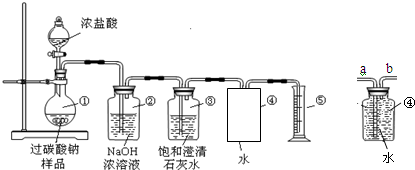
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com