

| A. | H2SO3?2H++SO32- K=10-5.2 | |
| B. | 在0.10 mol•L-1 H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 在pH=2.5该溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | 向pH为8.5的上述体系中通入极少量Cl2的过程中,溶液中c(HSO3-)和c(SO32-)均减小 |
分析 A.亚硫酸为二元弱酸,其电离分步进行;结合图象计算亚硫酸的Ka1;
B.根据亚硫酸溶液中的电荷守恒进行分析;
C.根据图象数据可知,pH=2.5时:c(HSO3-)>c(H2SO3);
D.pH=8.5时,亚硫酸氢根离子的浓度为0,所以通入氯气后其浓度不会变化.
解答 解:A.亚硫酸的第一步电离方程式为:H2SO3?H++HSO3-,根据图象可知,pH=0时,亚硫酸浓度为0.9mol/L,亚硫酸氢根离子浓度为0.24mol/L,此时氢离子浓度为1mol/L,则Ka1=$\frac{0.24×1}{0.9}$≈0.27,故A错误;
B.在0.10 mol•L-1 H2SO3溶液中,根据电荷守恒可得:c(H+)=c(HSO3-)+2•c(SO32-)+c(OH-),在该等式两边同时乘以氢离子浓度可得:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw,故B正确;
C.在pH=2.5该溶液中,根据图象曲线可知各离子浓度大小为:c(HSO3-)>c(H2SO3)>c(H+)>c(OH-),故C错误;
D.向pH为8.5的上述体系中通入极少量Cl2的过程中,亚硫酸根离子浓度减小,而亚硫酸氢根离子浓度基本不变,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确图象中曲线变化的含义为解答关键,注意掌握电荷守恒、物料守恒及质子守恒在判断离子浓度大小中的应用方法.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 金刚石比石墨更稳定 | |
| B. | 石墨比金刚石更稳定 | |
| C. | 1 mol金刚石比1 mol石墨的总能量低 | |
| D. | 1 mol金刚石转变为石墨需要吸收1.895 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1<n<2 | B. | 1<n<5 | C. | 2<n<4 | D. | 2<n<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
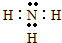 ,
,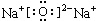 (或
(或 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上反应均可发生 | B. | 只有①不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Ca2+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 2×10-6 | 6×10-6 | 2×10-5 | 4×10-6 | 3×10-5 | 2×10-6 |
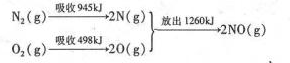
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式可能为C3H6O2 | |
| B. | 该物质不存在属于酯类的同分异构体 | |
| C. | 相对分子质量比乙酸大14n(n为整数) | |
| D. | 完全燃烧时生成CO2和H2O的质量比一定为11:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO与NO2的物质的量之比为1:5 | |
| B. | 反应后溶液中所含NO3-的物质的量浓度为0.5 mol/L | |
| C. | 被还原的硝酸的物质的量为0.15 mol | |
| D. | 上述过程转移电子总的物质的量为0.2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com