
| A. | 若有9.8gH2SO4参加反应,则转移电子的物质的量为1mol | |
| B. | 该反应的化学方程式为:5PbO2+2MnSO4+2H2SO4═Pb(MnO4)2+4PbSO4+2H2O | |
| C. | Pb(MnO4)2既是氧化产物又是还原产物 | |
| D. | X是MnSO4 |
分析 X是一种硫酸盐,且0.1mol X在该反应中失去0.5mol 电子,即1molX在该反应中失去5mol电子,根据元素守恒知,该元素是锰元素,生成物中锰元素是+7价,则X中锰元素显+2价,所以X是MnSO4,该反应方程式为:2MnSO4+5PbO2+2H2SO4=Pb(MnO4)2+4PbSO4+2H2O,以此解答该题.
解答 解:X是一种硫酸盐,且0.1mol X在该反应中失去0.5mol 电子,即1molX在该反应中失去5mol电子,根据元素守恒知,该元素是锰元素,生成物中锰元素是+7价,则X中锰元素显+2价,所以X是MnSO4,该反应方程式为:2MnSO4+5PbO2+2H2SO4=Pb(MnO4)2+4PbSO4+2H2O,
A.9.8g H2SO4参加反应,则n(H2SO4)=0.1mol,由方程式可知:2MnSO4~Pb(MnO4)2~2H2SO4 ~10mol电子,则0.1molH2SO4反应转移0.5mol电子,故A错误;
B.由以上分析可知反应的方程式为5PbO2+2MnSO4+2H2SO4═Pb(MnO4)2+4PbSO4+2H2O,故B正确;
C.反应中Mn元素化合价升高,Pb元素化合价降低,则Pb(MnO4)2既是氧化产物又是还原产物,故C正确;
D.由以上分析可知X是MnSO4,故D正确.
故选A.
点评 本题考查氧化还原反应及计算,为高频考点,把握元素的化合价变化及电子守恒为解答的关键,注意浓盐酸与PbO2发生的氧化还原反应,题目难度中等.


科目:高中化学 来源: 题型:填空题
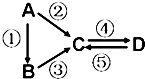 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象和结论 |
| 取一定量样品充分干燥,然后将样品加热分解,将产生的气体依次通过盛有无水硫酸铜的干燥管和盛有澄清石灰水的洗气瓶. | 无水硫酸铜变蓝色,澄清石灰水变浑浊 说明样品全部是2PbCO3•Pb(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ | B. | SO42- | C. | OH- | D. | Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得下图,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得下图,则曲线a、b、c、d所对应的实验组别可能是( )| 组别 | c(HCl)(mol•L-1) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 粉末状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 4-3-2-1 | B. | 1-2-3-4 | C. | 3-2-4-1 | D. | 3-4-2-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
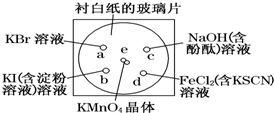 化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸电离的热化学方程式为:HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1 | |
| B. | 当V=20时,溶液中:c(OH-)=c(H+)+c(HF) | |
| C. | 当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol/L | |
| D. | 当V=20时,溶液中水的电离程度最大(忽略溶液温度的变化) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡是动态平衡 | |
| B. | 各反应物的浓度等于各生成物的浓度 | |
| C. | 正逆反应速率为零 | |
| D. | 反应物和生成物的浓度不再改变,反应已停止 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com