
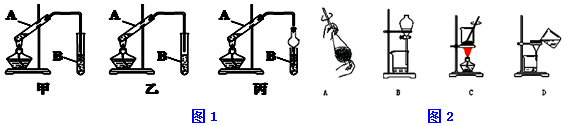
分析 (1)乙酸乙酯中混有乙酸、乙醇,应防止倒吸;
(2)乙酸乙酯在饱和碳酸钠溶液中溶解度较小,且可除去乙酸、乙醇;
(3)加入药品时应注意防止酸液飞溅,催化条件下,乙酸、乙醇发生酯化反应生成乙酸乙酯;
(4)分离乙酸乙酯,可用分液的方法;
(5)分液时,应先检查分液漏斗是否漏水或堵塞,在分液过程中注意保持漏斗内部与大气相通;
(6)用30g乙酸和40g乙醇反应,可计算理论生成乙酸乙酯的质量,进而计算产率.
解答 解:(1)甲中导管在液面下可发生倒吸,而乙和丙均可防止倒吸,乙和丙可顺利完成实验,故答案为:乙、丙;
(2)乙酸乙酯在饱和碳酸钠溶液中溶解度较小,且可除去乙酸、乙醇,发生反应的化学方程式为2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O,
故答案为:饱和Na2CO3溶液;2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O;
(3)加入药品时应注意防止酸液飞溅,可将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸,催化条件下,乙酸、乙醇发生酯化反应生成乙酸乙酯,方程式为CH3COOH+HOCH2CH3 $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:将浓H2SO4加入乙醇中,边加边振荡,最后加入乙酸;CH3COOH+HOCH2CH3 $?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(4)分离乙酸乙酯,可用分液的方法,应用A、B,故答案为:A、B;
(5)分液时,应先检查分液漏斗是否漏水或堵塞,在分液过程中注意保持漏斗内部与大气相通,可打开分液漏斗上口玻璃塞(或使漏斗内部与大气相通,或玻璃塞上的凹槽与漏斗口上的小孔对准),
故答案为:检查是否漏水或堵塞;打开分液漏斗上口玻璃塞(或使漏斗内部与大气相通,或玻璃塞上的凹槽与漏斗口上的小孔对准);
(6)30g乙酸的物质的量为$\frac{30g}{60g/mol}$=0.5mol,40g乙醇的物质的量为$\frac{40g}{46g/mol}$mol=0.87mol,根据反应方程式CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,可知乙醇过量,
设乙酸乙酯的理论产量为m,则
CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O
60 88
30g m
故m=$\frac{30g×88}{60}$=44g,
则产率为$\frac{37.4}{44}×100%$=85%.
故答案为:85%.
点评 本题考查有机物制备实验的评价,为高频考点,把握反应原理、实验技能、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验中防暴沸、防倒吸的分析,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:实验题
 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4NH3+5O2═4NO+6H2O | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2NaHCO3═Na2CO3+H2O+CO2 | D. | Cl2+2NaBr═2NaCl+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及其离子方程式 | 评 价 |
| A | 向沸腾的蒸馏水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O=Fe(OH)3↓+3H+ | 正 确 |
| B | 大理石溶于醋酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
| C | 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | 错误,产物不符合客观事实 |
| D | NaOH溶液中通入少量CO2反应:OH-+CO2=HCO3- | 正 确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
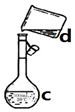 (1)现需配制0.1mol/LNaOH溶液500mL,装置是某同学转移溶液的示意图
(1)现需配制0.1mol/LNaOH溶液500mL,装置是某同学转移溶液的示意图查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③⑤ | C. | ①⑤⑥ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com