
 2Ca2++2K++Mg2++4
2Ca2++2K++Mg2++4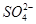 +2H2O
+2H2O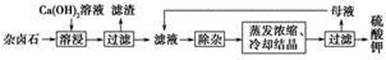
 ?
? CaCO3(s)+
CaCO3(s)+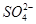

 CaCO3(s)+
CaCO3(s)+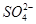 的平衡常数
的平衡常数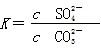 ,据Ksp(CaSO4).Ksp(CaCO3)可知:
,据Ksp(CaSO4).Ksp(CaCO3)可知: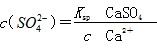 ,则有
,则有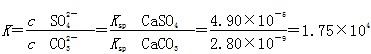 。
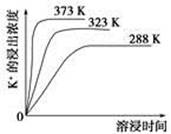
。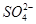 )均增大,从而析出CaSO4沉淀,K+留在滤液中。
)均增大,从而析出CaSO4沉淀,K+留在滤液中。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:不详 题型:单选题
A.检验亚硫酸钠试样是否变质: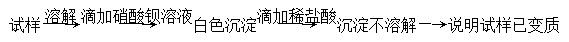 |
B.除去粗盐中含有的硫酸钙杂质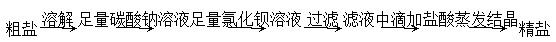 |
C.检验某溶液中是否含有Fe2+ |
| D.证明酸性条件H2O2的氧化性比I2强: |
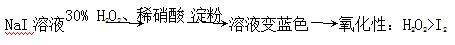
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
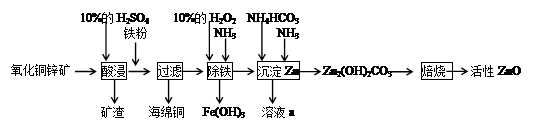
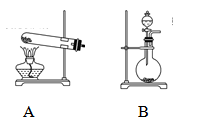
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
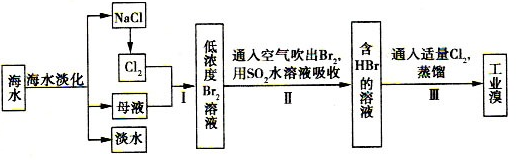
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
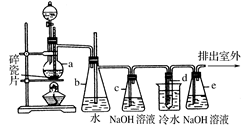
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
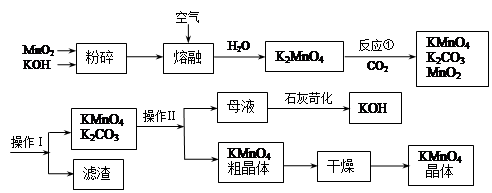
| A.84消毒液(NaClO溶液) |
| B.双氧水 |
| C.苯酚 |
| D.75%酒精 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ba(OH)2、KSCN、NaCl、Mg(NO3)2(FeCl3溶液) |
| B.NaNO3、NaHCO3、(NH4)2SO3、Na2SiO3(H2SO4溶液) |
| C.NH4Br、K2CO3、NaI、CaCl2(AgNO3溶液) |
| D.(NH4)3PO4、NaBr、CuSO4、AlCl3(KOH溶液) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
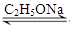 CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
| | 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138. 4 | 76.8 |
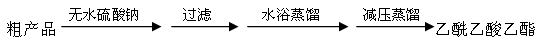
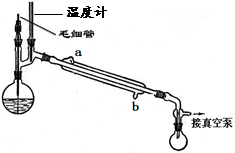
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用灼烧并闻气味的方法检验真皮衣料 |
| B.用淀粉和水检验食盐中的碘元素 |
| C.用食用碱(Na2CO3)溶液洗涤餐具上的油污 |
| D.用食醋除去热水壶中的水垢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com