
| A.氮 | B.氟 | C.硅 | D.钾 |
科目:高中化学 来源:不详 题型:单选题
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳酸钡的溶解度略大于硫酸钡,向硫酸钡的饱和溶液中加入较多的碳酸钠固体,会有碳酸钡生成 |
B.某温度T时,水的离子积常数为KW,该温度下将V1mLa mol?L-1的一元酸HA与V2mLb mol?L-1的一元碱BOH充分混合,若混合溶液中c(OH-)= mol?L-1,则此溶液不一定呈中性 mol?L-1,则此溶液不一定呈中性 |
| C.ⅣA族元素形成的氢化物的沸点从上到下依次递增,则ⅤA族元素所形成的氢化物的沸点从上到下也是依次递增 |
D.依据反应2C+SiO2 2CO↑+Si ,还原性:Si <C 2CO↑+Si ,还原性:Si <C |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 族 周期 | IA | | 0 | |||||
| 1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
| 2 | | | | | | ② | ③ | |
| 3 | ④ | ⑤ | | | | ⑥ | ⑦ | ⑧ |
| | 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | ||||
| 第一组 | 1 | 40 | FeCl3溶液 | 快速产生大量气泡 | 相同条件下,温度升高,化学反应速率加快 |
| 2 | 20 | A | 缓慢产生适量气泡 | ||
| 3 | 5 | FeCl3溶液 | 缓慢产生极少量气泡 | ||
| 第二组 | 4 | t | MnO2 | 快速产生大量气泡 | |
| 5 | 20 | 无 | 缓慢产生极少量气泡 | ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

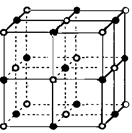
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.①②⑤ | D.①②④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A. 和 和  | B. 和 和  |
C. 和 和  | D. 和 和  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com