
| A. | 所需仪器有:100mL容量瓶、烧杯、玻璃棒、胶头滴管、托盘天平 | |
| B. | 将量取的浓盐酸先倒入容量瓶,再加入蒸馏水至刻度线,摇匀 | |
| C. | 将溶液转移入容量瓶,要用玻璃棒引流 | |
| D. | 定容时俯视刻度,所配溶液浓度偏小 |
分析 配制100mL 0.1000mol/L HCl溶液,用到100mL容量瓶、烧杯、玻璃棒、胶头滴管、量筒等仪器,实验时先将浓盐酸放在烧杯中稀释,用玻璃棒引流转移到容量瓶中,定容时注意眼睛与刻度平视,以此解答该题.
解答 解:A.由浓盐酸配制稀盐酸,应用量筒,不用托盘天平,故A错误;
B.将量取的浓盐酸先倒入烧杯稀释,不能直接倒入容量瓶中,故B错误;
C.配制,为防止液体流出,用玻璃棒引流,故C正确;
D.定容时俯视刻度,导致体积偏小,则所配溶液浓度偏大,故D错误.
故选C.
点评 本题考查了配制一定物质的量浓度溶液,为高频考点,侧重考查学生的分析能力和实验能力,明确配制原理和实验步骤是解题关键,注意量筒、容量瓶正确的使用方法,题目难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ③②①⑤④ | B. | ①②③④⑤ | C. | ②③①④⑤ | D. | ③⑤②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、Y均能燃烧,都有大量浓烟产生 | |
| B. | X既能使酸性高锰酸钾溶液褪色,也能使溴水褪色,还能发生加聚反应 | |
| C. | X属于苯的同系物 | |
| D. | Y的二氯代物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离程度始终增大 | |
| B. | $\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$先增大再减小 | |
| C. | 当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-),c(H+)=c(OH-) | |
| D. | 当加入氨水的体积为10mL时,溶液中的pH=7,由水电离出的c(H+)=1×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭 | |
| B. | 工业上电解熔融的MgCl2制Mg,推测:工业上电解熔融的AlCl3制Al | |
| C. | Fe与CuCl2溶液反应可以置换出Cu,推测:钠与CuCl2溶液反应也可以置换出Cu | |
| D. | Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,推测:Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
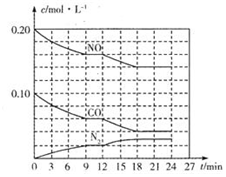 为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液呈酸性说明NH3•H2O是弱电解质 | |
| B. | 醋酸钠溶液中c(Na+)>c(CH3COO-) | |
| C. | 常温下相同pH的NaOH溶液和CH3COONa溶液中水电离出的OH-浓度相同 | |
| D. | 常温下,在1mol•L-1的盐酸中加入等体积等浓度的氨水,溶液导电能力减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com