
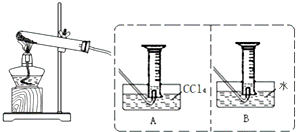
分析 (1)向一份溶液中滴入少量KSCN溶液,溶液变红色,说明有铁离子产生成,根据电子得失守恒可知Fe(NO3)2热分解生成了氧化铁,二氧化氮和氧气,据此答题;
(2)由于NO2和的密度均大于空气,所以将量筒从水槽中取出,正放在试验台上;
(3)由4Fe(NO3)2 $\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8NO2↑+O2↑可知产生NO2和O2的体积比为8:1,而4NO2~O2可恰好进入溶液中,剩余的NO2溶于水产生NO,因此收集到的气体为NO;
(4)根据三个反应2KNO3 $\frac{\underline{\;\;△\;\;}}{\;}$2KNO2↑+O2↑;2Cu(NO3)2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑; 2Fe(NO3)2 $\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+8NO2↑+O2↑,混合粉末充分加热后用排水法未收集到任何气体,说明三个反应中生成的气体物质的量之比n(NO2):n(O2)=4:1,通过选项答案验证;
(5)0.6mol由KNO3、Cu(NO3)2、Fe(NO3)3按等质的量之比混合,即各为0.2mol,所以溶液中硝酸根离子的物质的量为1.2mol,溶液中加入铜粉后发生的反应有3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O、Cu+2Fe3+=Cu2++2Fe2+,根据方程式计算.
解答 解:(1)向一份溶液中滴入少量KSCN溶液,溶液变红色,说明有铁离子产生成,根据电子得失守恒可知Fe(NO3)2热分解生成了氧化铁,二氧化氮和氧气,方程式为:4Fe(NO3)2 $\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8NO2↑+O2↑,
故答案为:4Fe(NO3)2 $\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8NO2↑+O2↑;
(2)将收集气体的量筒从水槽中取出的方法是用玻璃片在水槽里盖好量筒口,用食指摁紧玻璃片,由于NO2和的密度均大于空气,所以将量筒从水槽中取出,正放在试验台上,
故答案为:用玻璃片在水槽里盖好量筒口,用食指摁紧玻璃片,将量筒从水槽中取出,正放在试验台上;
(3)若用排水法收集时,4NO2~O2可恰好进入溶液中,由4Fe(NO3)2 $\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8NO2↑+O2↑可知产生NO2和O2的体积比为8:1,则54ml气体中有24ml NO2和6ml O2恰好进入溶液,另外24ml NO2溶于水产生8ml NO,则收集到的气体为8ml 气体,
故答案为:8;
(4)根据三个反应2KNO3 $\frac{\underline{\;\;△\;\;}}{\;}$2KNO2↑+O2↑;2Cu(NO3)2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑; 2Fe(NO3)2 $\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+8NO2↑+O2↑,混合粉末充分加热后用排水法未收集到任何气体,说明三个反应中生成的气体物质的量之比n(NO2):n(O2)=4:1,Cu(NO3)2受热分解的气体产物恰好符合物质的量之比n(NO2):n(O2)=4:1,所以其量为任意值,而KNO3和Fe(NO3)2按物质的量比为1:2混合受热分解的气体恰好符合n(NO2):n(O2)=4:1进入溶液,
故答案为:A;
(5)0.6mol由KNO3、Cu(NO3)2、Fe(NO3)3按等质的量之比混合,即各为0.2mol,所以溶液中硝酸根离子的物质的量为1.2mol,100mL 3mol/L的稀硫酸中,氢离子的物质的量为0.6mol,根据反应3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O可知,溶液中硝酸根离子过量,所以此反应中溶解的铜的质量为$\frac{0.6}{8}×3×64$g=14.4g,Fe(NO3)3的质的量为0.2mol,根据反应Cu+2Fe3+=Cu2++2Fe2+,此反应中溶解的铜的质量为$\frac{1}{2}$×0.2×64g=6.4g,所以总共溶解的铜的质量为6.4g+14.4g=20.8g,
故答案为:20.8g.
点评 本题考查了铁及其重要化合物的性质实验方案设计,侧重于离子检验、设计实验方案及操作、混合物的计算,综合性较强,难度较大,计算Cu的质量时注意硝酸根离子是过量的.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2(CaO):HCl | B. | MgO(Al2O3):NaOH | C. | CO2(SO2):Ca(OH)2 | D. | NaCl(NH4Cl):加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅含碳、氢元素的有机物称为烃 | |
| B. | 1,2-二溴乙烷是无色液体 | |
| C. | 溴苯的密度比水大 | |
| D. | 四氟乙烯(CF2=CF2)中含有碳碳双键,属于烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电路中流过0.05mol电子 | B. | 溶液中c(Cu2+)降低 | ||
| C. | 电解质溶液质量减少 | D. | 阳极铜消耗了1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
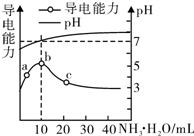
| A. | HR为强酸 | |
| B. | b点溶液呈中性,说明NH4R没有水解 | |
| C. | c点溶液存在c(NH4+)<c( R-) | |
| D. | b~c任意点溶液均有c(H+)×c(OH-)=l.0×l0-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2发生氧化反应 | |
| B. | 氧化性:Cr2O72->Fe3+>SO42- | |
| C. | 每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA | |
| D. | 若6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com