
 利用反应:Cu2Cl2+C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔.
利用反应:Cu2Cl2+C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔.| 5-1×3 |
| 2 |
| 5-1-1×4 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
| A、纯锌与稀硫酸反应 |
| B、粗锌跟浓硫酸反应 |
| C、粗锌跟稀硝酸反应 |
| D、将浸泡过CuSO4溶液的锌跟稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| O2 |
| 催化剂/△ |
| 乙醇 |
| 浓硫酸/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 金属离子 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| +O2 |
| +O2 |
| +H2O |
| +O2 |
| +O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
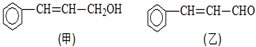

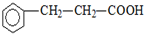 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉、蛋白质、油脂都是天然高分子化合物 |
| B、能与氢气发生加成反应的烃中一定含有碳碳双键 |
| C、煤的干馏、石油分馏、石油裂化都生成了新物质,都属于化学变化 |
| D、天然气、沼气、水煤气分别属于化石能源、可再生能源和二次能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com