
ClO2是饮用水消毒剂.用ClO2处理过的饮用水(pH为5.5~6.5)除含有ClO2外,常含有一定量对人体不利的ClO2﹣.为测定此饮用水中两者成分,进行如下实验:准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I﹣=I2+2ClO2﹣,反应结束后产生amol I2;继续调节溶液pH=1,又发生如下反应:ClO2﹣+4H+=2I2+Cl﹣+2H2O,反应结束后叉产生b mol I2.饮用水中c(ClO2﹣)= 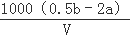 mol•L﹣ 1(用含字母的代数式表示).
mol•L﹣ 1(用含字母的代数式表示).
| 氯、溴、碘及其化合物的综合应用.. | |
| 专题: | 卤族元素. |
| 分析: | 依据化学方程式计算ClO2反应生成ClO2﹣,原水样中的ClO2﹣和ClO2反应生成ClO2﹣,调节PH和碘离子反应,依据反应ClO2﹣+4H++4I﹣═2I2+Cl﹣+2H2O,反应结束后产生b mol I2.计算得到ClO2﹣,物质的量共为0.5bmol,减去第一个反应生成的ClO2﹣,得到原水样中含有的ClO2﹣,得到饮用水中ClO2﹣的浓度. |
| 解答: | 解:准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I﹣═I2+2ClO2﹣,反应结束后产生amol I2;继续调节溶液pH=1,又发生如下反应:ClO2﹣+4H++4I﹣═2I2+Cl﹣+2H2O,反应结束后叉产生b mol I2;原水样中的ClO2﹣和ClO2反应生成ClO2﹣,调节PH后,ClO2﹣和碘离子反应,依据反应ClO2﹣+4H++4I﹣═2I2+Cl﹣+2H2O,反应结束后产生b mol I2.计算得到ClO2﹣,物质的量共为0.5bmol,减去第一个反应生成的ClO2﹣物质的量,依据化学方程式2ClO2+2I﹣═I2+2ClO2﹣,计算得到为2amol,得到原水样中含有的ClO2﹣物质的量=(0.5b﹣2a)mol,得到饮用水中ClO2﹣的浓度= 故答案为: |
| 点评: | 本题考查了化学反应的有关计算问题,注意根据反应方程式找出已知量的物质与待求量的关系. |


科目:高中化学 来源: 题型:
现有A、B、C、D四种短周期非金属元素,原子最外层电子数之和为19。在化合物中,这四种元素常见化合价均不止一种,但有一种相同的化合价。其部分性质如下:
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 最高正价或最低负价 | +6 | -4 | +4 | -3 |
下列说法错误的是( )
A.四种元素在化合物中具有一种相同的化合价,即+4
B.高温下B可从C的氧化物中置换出C的单质
C.四种元素的最高价含氧酸均为强酸
D.只由非金属元素组成且含D元素的化合物中可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物是重要的非金属材料。由石英砂制取高纯硅的主要化学反应有:
①粗硅的制取:SiO2+2C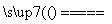 Si(粗)+2CO
Si(粗)+2CO
②粗硅中Si与Cl2反应:Si(s)+2Cl2(g)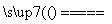 SiCl4(g) ΔH=-akJ/mol
SiCl4(g) ΔH=-akJ/mol
③粗硅的提纯反应:SiCl4(g)+2H2(g)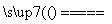 Si(s)+4HCl(g)'ΔH
Si(s)+4HCl(g)'ΔH
请回答下列问题:
(1)上述三个反应都属于________(填反应类型)。
(2)已知1mol Si固体中有2mol Si-Si键,1mol O2中有1mol O=O键,1mol SiO2固体中有4mol Si-O键。某些化学键数据如下:
| 化学键 | Si-O | Cl-Cl | H-H | H-Cl | Si-Si | O=O |
| 断键所需能量/(kJ·mol-1) | 460 | 243 | 436 | 431 | 176 | 498 |
根 据化学键数
据化学键数 据写出Si(s)在O2中完全燃烧生成SiO2的热化学方程式:_____________________________________________________ _________________________________________________________。
据写出Si(s)在O2中完全燃烧生成SiO2的热化学方程式:_____________________________________________________ _________________________________________________________。
(3)可由反应②和另一个反应______________________________ (填化学方程式)通过盖斯定律计算获得反应③的反应热,若该反应每生成1mol化合物的反应热ΔH=-bkJ/mol,则反应③的反应热ΔH=________kJ/mol(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如图(反应条件及其它产物已略去).下列说法不正确的是( )

|
| A. | 若甲是AlCl3溶液,则丁可能是NaOH溶液 |
|
| B. | 若甲是Fe,则丁可能是Cl2 |
|
| C. | 若丁是CO2,则甲可能为Mg |
|
| D. | 若丁是O2,则乙、丙的相对分子质量可能相差16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
水是生命之源,也是化学反应的主角.试回答下列问题:
P、Q、R是中学化学常见的三种有色物质(其组成元素均属于短周期元素),摩尔质量依次增大,它们均 能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出P、Q、R与水反应的化学方程式:
(1)P+H2O: ;
(2)Q+H2O: ;
(3)R+H2O: .
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1 NaHCO3溶液:K+、AlO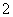 、Cl-、NO
、Cl-、NO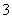
B.使甲基橙变红色的溶液:NH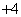 、Cu2+、ClO-、Na+
、Cu2+、ClO-、Na+
C.c(H+)=1×10-13 mol∙L-1的溶液中:Mg2+、Cu2+、SO42-、NO3-
D.遇苯酚变紫色的溶液:Na+、Mg2+、SO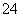 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.已知Ksp[Fe(OH)3]=4.0×10—38,则常温下Fe3++3H2O Fe(OH)3+3H+的平衡常数K=2.5×10—5
Fe(OH)3+3H+的平衡常数K=2.5×10—5
B.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L—1的NaOH标准溶液
C.电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D.催化剂通过降低化学反应的焓变加快化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组利用丙酮的溴代反应(CH3COCH3+B r2
r2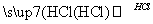 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系.反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定.在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系.反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定.在一定温度下,获得如下实验数据:
| 实验 | 初始浓度c/mol/L | 溴颜色消失所需时间t/s | ||
| 序号 | CH3COCH3 | HCl | Br2 | |
| ① ② ③ ④ | 0.80 1.60
0.80 | 0.20 0.20 0.40 0.20 | 0.0010 0.0010 0.0010 0.0020 | 290 145
580 |
分析实验数据所得出的结论不正确的是 ( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是( )
A.Na+、K+、Cl-、SO B.Cu2+、Fe2+、NO
B.Cu2+、Fe2+、NO 、SO
、SO
C.Na+、Ca2+、Cl-、ClO- D.K+、NH 、Cl-、SO
、Cl-、SO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com