
下列各类有机物:①饱和一元醇 ②饱和一元醛 ③饱和一元羧酸 ④饱和一元醇与饱和一元酸生成的酯 ⑤乙炔的同系物 ⑥苯的同系物 ⑦乙烯的同系物,完全燃烧时产生的水和二氧化碳的物质的量之比恒定的是
A.①③⑤⑦ B.②③④⑦ C.①④⑥ D.②③④⑤⑥
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
用数轴表示化学知识,并按某种共性对化学物质进行分类,有简明易记的效果。例如,根据碳素钢的含碳量,将其分为低碳钢、中碳钢、高碳钢,利用数轴分类法可将其表示为:
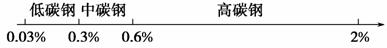
根据这一分类方法请回答:
(1)25 ℃将pH与溶液酸碱性的关系粗略地表示在如下数轴上:
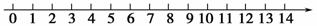
(2)某化学兴趣小组欲研究H2SO4、KCl、NaCl、Na2CO3、Na2SO3、NaOH六种物质的性质,对于如何研究,他们设计了两种研究方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验。
方法Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。
①根据方案Ⅰ进行分类时,经实验测得KCl、NaCl溶液的pH等于7;H2SO4溶液的pH小于7;Na2SO3、Na2CO3、NaOH溶液的pH大于7。由此有的同学按分类法思想把Na2SO3、Na2CO3与NaOH都划分为碱类是否合理?为什么?____________________________________________________________。
②在方案Ⅰ中,某同学发现盐类物质中的KCl、NaCl在与其他物质混合时现象相同,无法区分,请设计一种简单的方法区分这两种物质___________ ___________________________________________________________________________________________________________________________ ________。
________。
③在方案Ⅱ中,三种钠盐用其他物质中的________可加以区分,有关反应的化学方程式分别为_________________________________________________
_________________________________________________________________。
④该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na2SO3、Na2CO3、NaCl、NaOH和H2SO4、KCl两类。在用H2SO4鉴别四种含钠元素的物质时,Na2SO3和Na2CO3很容易得到了区分,但鉴别NaCl和NaOH时却陷入了困境,请设计一个实验来解决这一难题:__________ ______________________________________________________________________ ______________________________________________________________
______________________________________________________________
___________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
分析下表中各项的排布规律,有机物X是按此规律排布的第19项,下列有关X的组成、性质的说法中肯定错误的是
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
①是戊酸②是戊醇③是丁酸甲酯④在稀硫酸中易变质⑤一定能与钠反应
A.②⑤ B.①③④ C.③④ D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A. 熔化干冰和熔化NaCl晶体所克服的作用力相同
B. 氢键比分子间作用力强,所以它属于化学键
C. H2O是一种非常稳定的化合物,这是由于氢键所致
D. 冰的密度比水小,这是由于冰中存在氢键所致
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.3.4 g NH3中含有N-H键数为0.2 NA
B.100mL 1mol·L-1氨水中,含有OH- 离子数为0.1 NA
C.100mL 2 mol·L-1碳酸钠溶液中,Na+离子数为0.4 NA
D.一定条件下,密闭容器充入1molN2和3molH2充分反应,转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期律和周期表,揭示了元素之间的内在联系,反映了元素性质与它的原子结构的关系,在哲学、自然科学、生产实践各方面都有重要意义。下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
 |
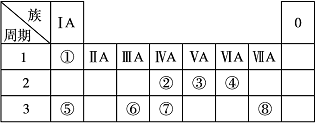
(1)这8种元素中金属性最强的元素是______(填元素符号或化学式,下同),元素最高价氧化物对应的水化物中酸性最强的酸是______;
(2)元素⑧的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是_________;
(3)③、⑤、⑦三种元素按原子半径由大到小的顺序排列为___________;
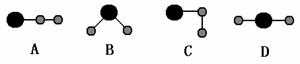 (4)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是___________。
(4)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是___________。
(5)w是第四周期与③同主族的元素。据此推测w不可能具有的性质是
A.最高正化合价为+5价 B.气态氢化物比NH3稳定
C.最高价氧化物的水化物的酸性比硝酸弱 D.单质在常温下可与氢气化合
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
|
|
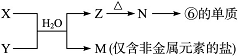
X溶液与Y溶液反应的离子方程式_______,M中阳离子的鉴定方法____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com