
| A. | 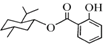 的分子式为C17H24O3 的分子式为C17H24O3 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙炔 | |
| C. | 有机硅聚醚( )可由单体 )可由单体 和 和 缩聚而成 缩聚而成 | |
| D. | 等质量的甲醇、甲醛、甲醚完全燃烧时的耗氧量依次递增 |
分析 A、依据此有机物的结构简式确定分子式即可;
B、高分子化合物…CH=CH-CH=CH-CH=CH-CH=CH…,其结构简式可以表示为 ,属于加聚产物,根据加聚产物的单体推断方法,凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半键闭合即可其单体为:CH≡CH;
,属于加聚产物,根据加聚产物的单体推断方法,凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半键闭合即可其单体为:CH≡CH;
C、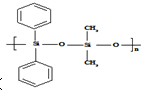 中含Si-O-Si的键结构;
中含Si-O-Si的键结构;
D、有机物燃烧反应为CxHyOz+(x+$\frac{y}{4}-\frac{z}{2}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,结合n=$\frac{m}{M}$分析消耗的氧.
解答 解:A、 ,由此结构简式可知,其分子中含有17个C、含有24个H,含有3个O,故分子式为:C17H24O3,故A正确;
,由此结构简式可知,其分子中含有17个C、含有24个H,含有3个O,故分子式为:C17H24O3,故A正确;
B、高分子化合物…CH=CH-CH=CH-CH=CH-CH=CH…,其结构简式可以表示为 ,属于加聚产物,根据加聚产物的单体推断方法,凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半键闭合即可其单体为CH≡CH,故B正确;
,属于加聚产物,根据加聚产物的单体推断方法,凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半键闭合即可其单体为CH≡CH,故B正确;
C、 中含Si-O-Si的键结构,可知该有机物由单体
中含Si-O-Si的键结构,可知该有机物由单体 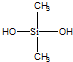 和
和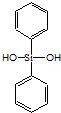 缩聚而成,故C正确;
缩聚而成,故C正确;
D、有机物燃烧反应为CxHyOz+(x+$\frac{y}{4}-\frac{z}{2}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O,等质量的甲醇、甲醛、甲醚完全燃烧时的耗氧量分别为$\frac{m}{32}$×(1+$\frac{4}{4}$-$\frac{1}{2}$)=$\frac{m}{21.3}$、$\frac{m}{30}$×(1+$\frac{2}{4}$-$\frac{1}{2}$)=$\frac{m}{30}$、$\frac{m}{46}$×(2+$\frac{6}{4}-\frac{1}{2}$)=$\frac{m}{15.3}$,可知甲醛消耗的氧气最少,故D错误;
故选D.
点评 本题考查较综合,涉及有机物的结构与性质、高聚物单体判断及有机燃烧反应的计算等,注重高频考点的考查,较好的训练学生分析及应用能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在该溶液中:Na+、SO42-、CH2O、Mg2+可以大量共存 | |
| B. | 该溶液中Fe3+的检验:Fe3++3SCN-=Fe(SCN)3↓ | |
| C. | 与NaHCO3溶液混合:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑ | |
| D. | 每腐蚀32gCu需要1mol/L该溶液500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 元素W和M的某些单质可作为水处理中的消毒剂 | |
| C. | 元素Y、Z、W的单质晶体属于同种类型的晶体 | |
| D. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 推测 | |
| A | 12Mg与水反应缓慢,20Ca与水反应较快 | 56Ba(IIA族)与水反应更快 |
| B | Si是半导体材料,同族Ge也是半导体材料 | Ⅳ族的元素都是半导体材料, |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Z>W>R | |
| B. | W与X、W与Z形成的化学键类型完全相同 | |
| C. | 对应的氢化物的热稳定性:R>W | |
| D. | Y的最高价氧化物对应的水化物是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | NaCl溶液 | 电石 | 酸性KMnO4 | 乙炔具有还原性 | |
| B | 浓硝酸 | Na2CO3 | 苯酚钠溶液 | 酸性:硝酸>碳酸>苯酚 | |
| C | 浓盐酸 | KMnO4 | FeBr2 | 氧化性:Cl2>Br2 | |
| D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用装置甲检验溶液中是否有K+ | B. |  用装置乙制取并收集少量NH3 | ||
| C. |  用装置丙进行喷泉实验 | D. |  用装置丁加热熔融NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com