
| A. | 0.1mol 对苯二甲酸中含有双键的数目为0.2NA | |
| B. | 标准状况下,11.2 L甲醛所含的σ键数目为2NA | |
| C. | 2mol NO和1mol O2混合,在密闭容器中充分反应后,容器内的分子数等于2NA | |
| D. | 1mol Fe 与足量的硝酸反应,转移的电子数为0.2NA |
分析 A、对二苯甲酸中只含2条碳氧双键;
B、标况下甲醛为气体;
C、2mol NO和1mol O2混合后生成2molNO2,但NO2中存在平衡:2NO2?N2O4;
D、铁和足量的硝酸反应后变为+3价.
解答 解:A、对二苯甲酸中只含2条碳氧双键,苯环中无双键,故0.1mol对二苯甲酸中含0.2NA条双键,故A正确;
B、标况下甲醛为气体,故11.2L甲醛的物质的量为0.5mol,而甲醛中含3条σ键,则含有的σ键为1.5NA个,故B错误;
C、2mol NO和1mol O2混合后生成2molNO2,但NO2中存在平衡:2NO2?N2O4,导致分子个数小于2NA个,故C错误;
D、铁和足量的硝酸反应后变为+3价,故1mol铁反应后转移3NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 二者互为同系物 | |
| B. | 聚乙烯是乙烯的缩聚产物 | |
| C. | 二者都能使溴的四氯化碳溶液褪色 | |
| D. | 等质量的乙烯和聚乙烯分别完全燃烧消耗等物质的量的氧气,生成等量的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的系统命名是2,6-二甲基辛烷
的系统命名是2,6-二甲基辛烷 的名称是1,3-二甲基苯
的名称是1,3-二甲基苯查看答案和解析>>
科目:高中化学 来源: 题型:选择题
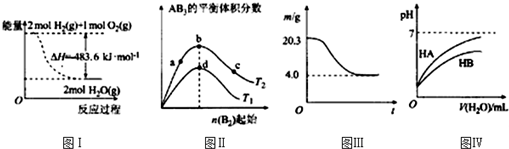
| A. | 图Ⅰ表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ•mol-1 | |
| B. | 图Ⅱ表示反应A2(g)+3B2(g)?2AB3(g),达到平衡时A2的转化率大小为:b>a>c | |
| C. | 图Ⅲ表示0.1mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| D. | 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
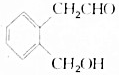 .A可以被新制Cu(OH)2氧化为B;B能在浓硫酸存在和加热时发生分子内的酯化反应生成C,C分子中有一个含氧的六元环.回答下列问题:
.A可以被新制Cu(OH)2氧化为B;B能在浓硫酸存在和加热时发生分子内的酯化反应生成C,C分子中有一个含氧的六元环.回答下列问题: .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$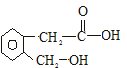 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步 骤 |  | 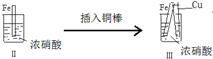 | |
| 现 象 | 铁表面产生大量无色气泡,液面上方变为红棕色 | 铁表面产生少量红棕色气泡后,迅速停止 | 铁、铜接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2→2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| D. | 针对III中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com