
下图烧杯中盛有稀硫酸,则:
(1)A中进行的离子反应方程式为 。
(2)B中各电极的电极反应式:负极: ;正极: 。
(3)C中被腐蚀的金属是 ,正极反应 。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是 。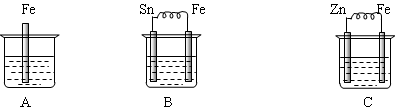
(12分)每小题2分
(1)Fe+2H+==Fe2++H2↑
(2)Fe-2e-==Fe2+; 2H++2e-==H2↑
(3)Zn; 2H++2e-==H2↑
(4)B>A > C
解析试题分析:(1)铁是活泼的金属,很容易的置换出酸中的氢,离子方程式为Fe+2H+==Fe2++H2↑。
(2)Fe的活泼性大于Sn的活泼性,Fe为负极,失去电子,发生氧化反应,电极反应式为Fe-2e-==Fe2+,Sn为正极,电极反应式为2H++2e-==H2↑。
(3)Zn的活泼性大于Fe的活泼性,Zn是负极,失去电子,发生氧化反应,故被溶解的金属是Zn。正极反应式为2H++2e-==H2↑。
(4)金属腐蚀的程度为:在原电池中做负极的腐蚀程度最大,发生化学反应的次之,做正极的腐蚀的最弱,故三烧杯中铁被腐蚀的速率由快到慢的顺序是B>A > C。
考点:原电池的工作原理 离子方程式的书写 电池反应式的书写
点评:本题考查的是原电池的工作原理,题目难度中,在原电池中,一般活泼金属做负极,不活泼金属或惰性电极或碳棒做正极,负极的活泼性大于正极的活泼性。负极质量减少,正极质量增加或有气泡冒出。电子由负极流向正极,电流由正极流向负极。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:

图2-1
(1)向烧杯中慢慢加入与稀硫酸密度相同(均大于1 g·cm-3)的Ba(OH)2溶液至恰好反应完全,在实验中可观察到的现象有:①_______________;②_______________。烧杯中所发生反应的化学方程式为____________________________________________________。
(2)若向烧杯中加入的不是Ba(OH)2溶液,而是锌粒,在实验中可观察到的现象有:①______________________________;②_______________________________。烧杯中发生反应的离子方程式为__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一烧杯中盛有稀硫酸溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,如下图所示。向烧杯里缓缓注入与稀H2SO4等密度的Ba(OH)2溶液至恰好完全反应,在此实验过程中:

(1)观察到烧杯里的实验现象是_____________________________________。
(2)写出实验过程中反应的离子方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届河南省灵宝市高一下学期第二次检测化学理科试卷(解析版) 题型:填空题
下图烧杯中盛有稀硫酸,则:
(1)A中进行的离子反应方程式为 。
(2)B中各电极的电极反应式:负极: ;正极: 。
(3)C中被腐蚀的金属是 ,正极反应 。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)观察到烧杯里的实验现象是____________________________________________________。
(2)写出实验过程中反应的离子方程式______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com