
电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取 ( )
A.电子的运动轨迹图像 B.原子的吸收光谱
C.电子体积大小的图像 D.原子的发射光谱
科目:高中化学 来源: 题型:
某温度下,在一容积可变的容器中,反应2A(g)  B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是( )
B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是( )
A、充入1mol稀有气体氦(He),平衡将向逆反应方向移动
B、充入A、B、C各1mol,平衡将向正反应方向移动
C、将A、B、C各物质的量都减半,C的百分含量不变
D、加入一定量的A气体达平衡后,C的百分含量一定增加
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示: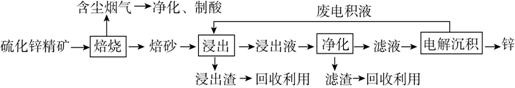
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____________________。
(2)浸出液“净化”过程中加入的主要物质为________,其作用是________。
(3)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是________。
(4)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生主要反应的离子方程式为___________________________________________。
(5)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。” 该炼锌工艺过程主要反应的化学方程式为_________________________________________________。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
Ⅱ.工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
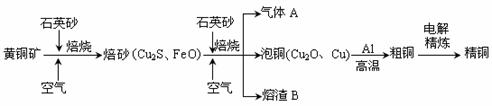
(6) 焙砂含Cu量为20%~50%。转炉中,将焙砂加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。焙砂中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、___________________________;
(7)假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量 mol;
② 6 mol CuFeS2和14.25 mol O2反应,理论上可得到 molCu。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事实与所得出的相应结论合理的是( )
| 选项 | 实验事实 | 结论 |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | 将燃着的镁条伸入盛有CO2的集气瓶中继续燃烧 | 还原性:Mg>C |
| C | SO2可以使酸性KMnO4溶液褪色 | SO2具有漂 白性 |
| D | 将铁粉放入稀HNO3中充分反应后,滴入KSCN溶液无明显现象 | 稀HNO3不能将Fe氧化成Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.高炉炼铁是冶炼铁的主要方法,发生的主要反应为
Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) ΔH
(1)已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH1
C(石墨)+CO2(g)===2CO(g) ΔH2
则ΔH=________(用含ΔH1、ΔH2代数式表示)
(2)高炉炼铁反应的平衡常数表达式K=________。
(3)在T ℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
①甲容器中CO的平衡转化率为________。
②下列说法正确的是________(填字母)。
A.若容器压强恒定,反应达到平衡状态
B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的
D.增加Fe2O3就能提高CO的转化率
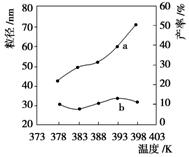
Ⅱ.纳米MgO可用尿素与氯化镁合成。某小组研究该反应在温度在378~398 K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
| 编号 | 温度/K | 反应 时间/h | 反应物物质 的量配比 | 实验目的 |
| ① | 378 | 3 | 3∶1 | 实验②和④探究______________ 实验②和______探究反应时间对产率的影响 |
| ② | 378 | 4 | 4∶1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4∶1 |
下图为温度对纳米MgO产率(曲线a)和粒径(曲线b)的影响,请归纳出温度对纳米MgO制备的影响:__________________(写出一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子排布式的原子中,半径最大的是
A ls22s22p63s23p5 B 1s22s22p3 C 1s22s22p2 D 1s22s22p63s23p2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A、X与Y形成化合物是,X可以显负价,Y显正价
B、气态氢化物的稳定性:HmY小于HnX
C、第一电离能可能Y小于X
D、最高价含氧酸的酸性:X对应的酸的酸性弱于Y对应的酸的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.同温同压下,相同体积的物质,其物质的量一定相等
B.不同的外界条件下,等物质的量的甲烷和一氧化碳所含的分子数不一定相等
C.1 L一氧化碳气体一定比1 L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若体积相等,则分子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

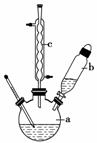
制备苯乙酸的装置示意图如右(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL 70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是____________________________________________;
仪器c的名称是__________________________,其作用是______________________________。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是________________________。下列仪器中可用于分离苯乙酸粗品的是________(填标号)。
A.分液漏斗 B.漏斗
C.烧杯 D.直形冷凝管
E.玻璃棒
(3)提纯粗苯乙酸的方法是________________,最终得到44 g纯品,则苯乙酸的产率是________________。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是________________________________。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com