
【题目】如图:A处通入氯气,关闭B时,C中红色布条颜色无变化;当打开B时,C处红色布条颜色褪去。则相关判断正确的是
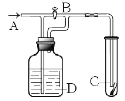
A.通入的Cl2含有水蒸气B.D中不可能是浓H2SO4
C.D中可能是水D.D中可能是饱和食盐水
科目:高中化学 来源: 题型:
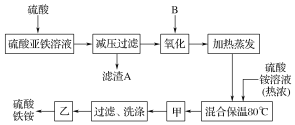
【题目】硫酸铁铵[aFe2(SO4)3·b(NH4)2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计如图工艺流程制取硫酸铁铵。
请回答下列问题:
(1)硫酸亚铁溶液加硫酸酸化的主要目的是________。
(2)下列物质中最适合的氧化剂B是________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲的名称是_____。
(4)上述流程中,氧化之后和加热蒸发之前,需加入少量______(填化学式),检验Fe2+是否已全部被氧化的方法为_______________。
(5)称取14.00 g所得产品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份溶液中加入足量NaOH溶液,过滤、洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba(NO3)2的溶液,恰好完全反应,则该硫酸铁铵的化学式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室买回的硫酸试剂标签的部分内容。判断下列说法正确的是( )

A. 该硫酸的浓度为9.2 mol·L-1
B. 配制480 mL 4.6 mol·L-1的稀硫酸需该H2SO4125mL
C. 该硫酸与等体积水混合质量分数变为49%
D. 取该硫酸100 mL,则浓度变为原来的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。
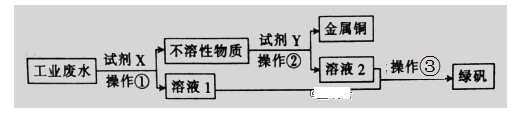
(1)操作③的名称为__________ 。
(2)试剂X为__________(填化学式),操作②涉及的离子反应方程式为__________ 。
Ⅱ.(3)研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5 价砷(As)元素,但它对人体是无毒的,砒霜的成分是 As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素 C=砒霜。该使人中毒过程中维生素 C 是________(填“氧化剂”或“还原剂)
(4)已知某反应中反应物和生成物有:KMnO4、H2SO4、MnSO4、H2C2O4、K2SO4、H2O和一种未知物X。
①若0.5 molH2C2O4在反应中失去1 mol电子生成X,则X的化学式为__________ 。
②将氧化剂和还原剂及配平的系数填入下列方框中,并用单线桥标出电子转移的方向和 数目。__________
![]()
③若已知H2C2O4为弱酸,试写出该反应的离子方程式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图:______________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式:__________________________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1;H2(g)+
H2(g)+2O2(g)=H3AsO4(s) ΔH1;H2(g)+![]() O2(g)=H2O(l) ΔH2;2As(s)+
O2(g)=H2O(l) ΔH2;2As(s)+![]() O2(g)=As2O5(s) ΔH3。则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=________________________。
O2(g)=As2O5(s) ΔH3。则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=________________________。
(4)298 K时,将20mL 3x mol·L-1Na2AsO3、20mL 3x mol·L-1 I2和20mL NaOH溶液混合,发生反应:AsO33- (aq)+I2(aq)+2OH-(aq)=AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO43- )与反应时间(t)的关系如图所示。
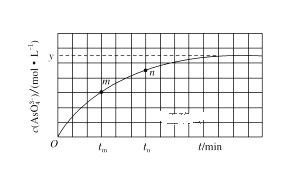
①下列可判断反应达到平衡的是________(填选项字母)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.![]() 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1
②tm时,v正______v逆(填“大于”“小于”或“等于”)。
③tm时的v逆____tn时的v逆(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)S2-的结构示意图为__________;7 g 35Cl2所含的中子数为________。
(2)下列物质中,能导电的有____________;属于电解质的是_________。
①石墨②CO2 ③液态HCl ④Na2CO3固体 ⑤熔融Al2O3 ⑥葡萄糖 ⑦KOH溶液
(3)工业上电解饱和食盐水制氯气的化学方程式为_____________,用双线桥表示其电子转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“共生系统”能很大程度上提高经济效益。研究硫酸工业尾气的“共生系统”具有重要意义。回答下列问题:
(1)工业上,将Na2CO3和Na2S以合适的物质的量比配成溶液,吸收富集的SO2,可制取重要的化工原料Na2S2O3,同时放出CO2。该反应的化学方程式为___________________。
(2)工业上,将富含SO2的工业尾气降温液化,收集液态SO2。用液态SO2、硫磺(用S表示)、液氯为原料,在200℃~250℃活性炭催化条件下合成氯化剂SOCl2。该反应中氧化剂与还原剂的物质的量之比为________________。
(3)SOCl2分子的空间构型为______________。下列关于O、S、Se三种同主族元素的叙述正确的是____________(填序号)。
a.沸点:H2O>H2S>H2Se
b.H2O分子中H—O—H键的键角小于H2S分子中H—S—H键的键角
c.热稳定性H2O>H2S>H2Se
d.CS2是一种直线型分子,分子中C、S原子都满足8电子稳定结构
(4)氯化亚砜(SOCl2,易挥发液体,易水解)常用作脱水剂。ZnCl2·xH2O制取无水ZnCl2流程如图所示:
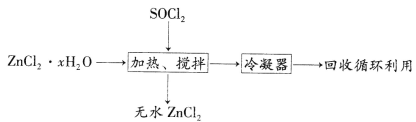
①利用SOCl2和ZnCl2·xH2O混合加热可制得无水ZnCl2的原因是_________________________________(用化学方程式和必要的文字解释)。
②甲同学认为SOCl2也可用于FeCl3·6H2O制取无水FeCl3,但乙同学认为该过程会发生氧化还原反应。要验证乙同学观点是否正确,可选择下列试剂中的___________(填序号)。
a.K3[Fe(CN)6]溶液 b.BaCl2溶液和稀盐酸
c.AgNO3溶液和稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )

A.反应①②③④⑤均属于氧化还原反应,反应③还属于置换反应
B.反应⑤说明该条件下铝可用于制熔点较高的金属
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D.反应①中氧化剂与还原剂的物质的量之比为1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com