
| A. | 对于吸热反应,由于吸收热量后反应体系的温度升高 | |
| B. | 对于吸热反应,生成物的总能量,高于反应物的总能量 | |
| C. | 对于放热反应,放出热量后反应体系的温度降低 | |
| D. | 对于放热反应,生成物的总能量高于反应物的总能量 |
分析 A、体系的温度高低不仅与吸热放热有关,还与反应条件有关;
B、吸热反应,生成物的总能量高于反应物的总能量;
C、体系的温度高低不仅与吸热放热有关,还与反应条件有关;
D、放热反应,生成物的总能量低于反应物的总能量.
解答 解:A、体系的温度高低不仅与吸热放热有关,还与反应条件有关,不能依据反应吸热放热确定反应体系的温度变化,故A错误;
B、生成物的总能量高于反应物的总能量,则为吸热反应,故B正确;
C、体系的温度高低不仅与吸热放热有关,还与反应条件有关,不能依据反应吸热放热确定反应体系的温度变化,故C错误;
D、生成物的总能量低于反应物的总能量,反应放热,故D错误;
故选B.
点评 本题考查了化学反应中都有能量变化、生成物的总能量、反应物的总能量与放热吸热的关系等,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
 一氧化碳和氢气反应可生成甲醛:CO(g)+H2(g)?HCHO(g)△H<0,一定温度下,向恒容密闭容器中充入等物质的量的H2、CO和HCHO三种气体,测得CO的净反应速率(即正反应速率减去逆反应速率)随时间的变化曲线如图所示,其中第5min和第7min时分别改变了反应的一个条件,下列说法正确的是( )
一氧化碳和氢气反应可生成甲醛:CO(g)+H2(g)?HCHO(g)△H<0,一定温度下,向恒容密闭容器中充入等物质的量的H2、CO和HCHO三种气体,测得CO的净反应速率(即正反应速率减去逆反应速率)随时间的变化曲线如图所示,其中第5min和第7min时分别改变了反应的一个条件,下列说法正确的是( )| A. | 前4 min阴影部分的值为CO的物质的量浓度的变化量 | |
| B. | 前4 min反应向正方向进行 | |
| C. | 第5 min时改变的条件可能为向容器中再分别充入1 mol H2、1 mol CO和1 mol HCHO | |
| D. | 第7 min时改变的条件可能为降低反应温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相 关 信 息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三种必需元素之一,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝. |
| D | 室温下其单质呈淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂. |
| F | 它是人体不可缺少的微量元素,其单质也是应用最广的金属原材料,常用于制造桥梁、轨道等. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.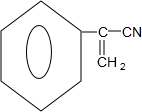 ,E中含氧官能团的名称为羧基.
,E中含氧官能团的名称为羧基. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.回答下列问题(所有元素均用元素符号表示):
原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.回答下列问题(所有元素均用元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A在周期表中的位置为第三周期ⅢA族.
,A在周期表中的位置为第三周期ⅢA族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com