
| A. | 葡萄糖和蛋白质等高分子化合物是人体必需的营养物质 | |
| B. | 将草木灰和硫酸铵混合施用,肥效更高 | |
| C. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 | |
| D. | 棉花的主要成分是纤维素,石英玻璃、陶瓷和水泥均属于硅酸盐产品 |
分析 A.葡萄糖的相对分子质量在10000以下;
B.草木灰和硫酸铵混合施用,相互促进水解,含N量减少;
C.二氧化碳导致温室效应;
D.石英玻璃主要成分二氧化硅.
解答 解:A.葡萄糖的相对分子质量在10000以下,不是高分子,而蛋白质为高分子,均为人体必需的营养物质,故A错误;
B.草木灰水解显碱性,硫酸铵水解显酸性,混合施用,肥效降低,故B错误;
C.用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应,故C正确;
D.石英玻璃主要成分二氧化硅,是氧化物不是硅酸盐,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高考高频考点,把握官能团与性质、物质组成、化学与环境保护等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
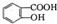 与适量NaHC03溶液反应制备
与适量NaHC03溶液反应制备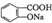
| A. | 只有①③④ | B. | 只有①③ | C. | 只有② | D. | 都不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
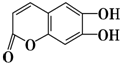 中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用.有机物M是中药狼把草的成分之一,其结构如图所示.下列叙述不正确的是( )
中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用.有机物M是中药狼把草的成分之一,其结构如图所示.下列叙述不正确的是( )| A. | M是芳香族化合物,它的分子式为C9H6O4 | |
| B. | 1 mol M最多能与3 mol Br2发生反应 | |
| C. | 1 mol M最多能与含有3 mol NaOH的溶液发生反应 | |
| D. | 在一定条件下能发生取代、加成、水解、氧化等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 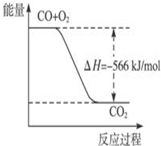 图可表示由CO生成CO2的反应过程和能量关系 | |
| B. | CO的燃烧热为566 kJ/mol | |
| C. | Na2O2(s)+CO2(s)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋、石灰水验证蛋壳中含有碳酸盐 | |
| B. | 用碘酒检验汽油中是否含有不饱和烃 | |
| C. | 用鸡蛋清、食盐、水完成蛋白质的溶解、盐析实验 | |
| D. | 用米汤检验食用加碘盐(含KIO3)中含有碘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com