
分析 (1)此蓄电池在充电时,电池负极应与外加电源的负极连接作阴极,得电子发生还原反应;
(2)以铜为电极,用此蓄电池作电源,电解以下溶液,开始阶段发生反应:Cu+2H2O═Cu(OH)2+H2↑,说明阴极为水中氢离子得电子发生还原反应,据此判断;
第(1)题依据电池反应分析,充电为电解池,放电为原电池;放电过程中原电池的负极上失电子发生氧化反应,正极上发生还原反应;
(3)放电是原电池反应,NiO2+Fe+O$?_{充电}^{放电}$ Fe(OH)2+Ni(OH)2,负极:Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-;工作一段时间后蓄电池内部消耗了0.36g水,n(H2O)=$\frac{0.36g}{18g/mol}$=0.02mol,
①由电子守恒可知,电解N(NO3)x溶液时,某一极增加了agN,2N~2xe-;
②n(H2O)=$\frac{0.36g}{18g/mol}$=0.02mol,根据方程式,电池转移电子为0.02mol,由离子放电顺序可知,电解含有0.1mol•L-1的CuSO4溶液100mL,阳极上氢氧根离子放电生成氧气,阴极上铜离子得电子,以此计算;
(4)燃料电池中,正极发生的反应一定是氧气得电子发生还原反应的过程;
(5)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
②CH3OH(g)═CH3OH(l)△H=-b kJ•mol-1;
③2H2(g)+O2(g)═2H2O(g)△H=-c kJ•mol-1;
④H2O(g)═H2O(l)△H=-d kJ•mol-1.
根据盖斯定律,-①-②+$\frac{3}{2}$×③+2×④计算得到.
解答 解:(1)此蓄电池在充电时,电池负极应与外加电源的负极连接作阴极,得电子发生还原反应,反应式为:Fe(OH)2+2e-═Fe+2OH-;故答案为:负;Fe(OH)2+2e-═Fe+2OH-;
(2)以铜为电极,用此蓄电池作电源,电解以下溶液,开始阶段发生反应:Cu+2H2O═Cu(OH)2+H2↑,说明阴极为水中氢离子得电子发生还原反应,所以可以为活泼的金属阳离子的溶液,故BCE符合,AD不符合,故选:BCE;
(3)①负极:Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-;
工作一段时间后蓄电池内部消耗了0.36g水,n(H2O)=$\frac{0.36g}{18g/mol}$=0.02mol,则电池转移电子为0.02mol;
由电子守恒可知,电解N(NO3)x溶液时,某一极增加了agN,2N~2xe-,则设N的相对原子质量为RRR,
2M~2xe-
2R 2x
a 0.02mol
解得R=50ax,故答案为:50ax;
②n(H2O)=$\frac{0.36g}{18g/mol}$=0.02mol,根据方程式,电池转移电子为0.02mol,由离子放电顺序可知,电解含有0.1mol•L-1的CuSO4溶液100mL,阳极上氢氧根离子放电生成氧气,阴极上铜离子得电子,
阳极上:4OH--4e-=2H2O+O2↑,
4 4 1
0.02mol 0.02mol 0.005mol
则阳极生成0.005mol气体,体积为0.005mol×22.4L/mol=0.112L,
阴极上:
Cu2++2e-=Cu
1 2 1
0.01mol 0.02mol 0.01mol
则氢氧根离子失电子减少0.02mol,氢离子增加0.02mol,所以溶液中氢离子增加0.02mol;
c(H+)=$\frac{0.02}{2}$=0.01mol/L,所以pH=2,
故答案为:0.112L;2;
(4)燃料电池中,正极发生的反应一定是氧气得电子的过程,该电池的电解质环境是熔融碳酸盐,所以电极反应为:O2+2CO2+4e-=2CO32- (或2O2+4CO2+8e-=4CO32-),故答案为:O2+2CO2+4e-=2CO32- (或2O2+4CO2+8e-=4CO32-);
(5)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
②CH3OH(g)═CH3OH(l)△H=-b kJ•mol-1;
③2H2(g)+O2(g)═2H2O(g)△H=-c kJ•mol-1;
④H2O(g)═H2O(l)△H=-d kJ•mol-1.
根据盖斯定律,-①-②+$\frac{3}{2}$×③+2×④得到CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H△H=-△H1-△H2+$\frac{3}{2}$△H3+2△H4=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1,则CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1.
点评 本题考查了盖斯定律的应用、原电池、电解池原理的分析判断和计算应用,注意混合电解中电子守恒的计算应用,掌握基础是关键,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
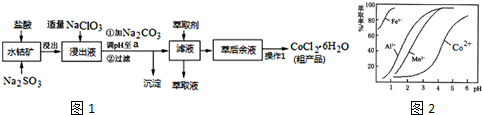
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y与R同族,Y的氢化物常温下为无色无味的液体,X与Y可形成直线形分子XY2,Z的基态原子p轨道上电子总数为7,T2+离子的3d轨道上有3个电子.
X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y与R同族,Y的氢化物常温下为无色无味的液体,X与Y可形成直线形分子XY2,Z的基态原子p轨道上电子总数为7,T2+离子的3d轨道上有3个电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
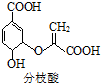
| A. | 分子中含有3种含氧官能团 | |
| B. | 可发生取代、加成、消去、加聚等反应 | |
| C. | 该物质的分子式为C10H10O6 | |
| D. | 1mol分枝酸最多可与3molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
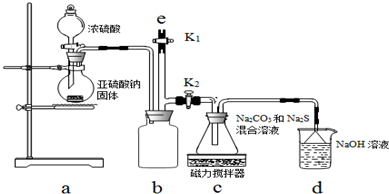
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计 | 观察或记录 | 结论或解释 |
| A | 将浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 浓硝酸的还原产物是NO2 |
| B | 测某铵盐溶液的pH | pH>7 | NH4+水解生成NH3•H2O,使溶液显碱性 |
| C | 用湿润的淀粉碘化钾试纸检验某气体 | 试纸变蓝 | 该气体一定是Cl2 |
| D | 将盛少量水的分液漏斗静置、倒置、将塞子旋转1800后再次倒置 | 漏斗口和活塞不漏水 | 分液漏斗不漏液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
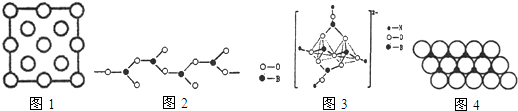
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉、麻、蚕丝的成分都是纤维素 | |
| B. | 地沟油的主要成分是高级脂肪酸甘油酯.可用于制肥皂 | |
| C. | 石油分馏的目的是为了获得乙烯、丙烯和1,3-丁二稀 | |
| D. | 乙醇,过氧化氢和臭氧可用于消毒.均体现氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com