
【题目】β-氮化碳的硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示。下列说法不正确的是( )
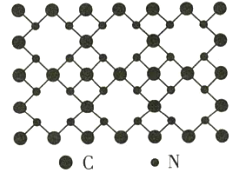
A.该晶体中的碳、氮原子都满足8电子稳定结构
B.该晶体中碳显+4价,氮显-3价
C.该晶体中每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
D.该晶体的分子式为C3N4
【答案】D
【解析】
氮化碳硬度大,为原子晶体,组成微粒为原子,由氮化碳的二维晶体结构可知,晶体中每个C原子与4个N原子相连,而每个N原子与3个C原子相连,由于非金属性N>C,则N为-3价、C为+4价,且N原子有一个孤电子对,以此解答该题。
A. 根据图中结构可知,每个碳原子周围有四个共价键,每个氮原子周围有三个共价键,碳原子最外层有4个电子,形成四个共价健后成8电子稳定结构,氮原子最外层有5个电子,形成三个共价键后,也是8电子稳定结构,故A正确;
B. 氮元素的电负性大于碳元素,所以在氮化碳中氮元素显3价,碳元素显+4价,故B正确;
C. 根据图知,每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连,故C正确;
D. 因为氮化碳是原子晶体,不存在分子,故没有分子式,故D错误。
故选:D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素次外层电子数是最外层电子数的![]() ,其外围电子的轨道表示式是 ________ 。
,其外围电子的轨道表示式是 ________ 。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是 _______ ,在元素周期表中的位置是 _______ 。
(3)C元素基态原子的轨道表示式是下图中的 ____________ (填序号),另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合 ____________ (填序号)。
①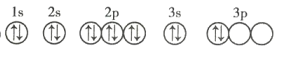
②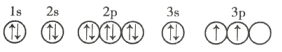
A 能量最低原则 B 泡利不相容原理 C 洪特规则
(4)元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能a叫作第一电离能(设为E)。第三周期元素的第一电离能示意图如图所示:
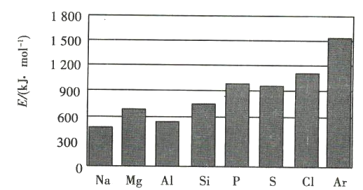
①同周期内,随着原子序数的增大,E值变化的总趋势是 ____________ ;
②根据图中提供的信息,可推断出E氧 ______ E氟(填“>”“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,可推断出E镁 ____________ E钙。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮废水是生活中常见污染物之一,可用电解法加以去除。实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl混合溶液来模拟该过程。
(1)电解处理氨氮废水电解过程中,溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示:
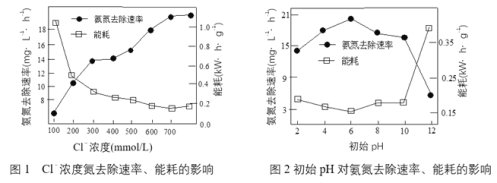
①根据图中数据,处理废水合适的条件是_______________。
②实验中发现阳极会持续产生细小气泡,气泡上浮过程中又迅速消失。结合图1,用电极反应式和离子方程式解释Cl-去除氨氮的原因_______________。
③图1中当Cl-浓度较低时、图2中当初始pH达到12时,均出现氨氮去除速率低而能耗高的现象,共同原因是_______________。
(2)氨的定量测定使用下图装置检测废水中的氨氮总量是否合格。
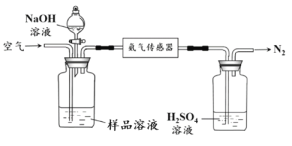
①利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:_______________。
②若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol,则样品混合液中氨氮(以氨气计)含量为_______________mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有前四周期的5种元素的部分信息如下表所示:
元素代号 | 元素部分信息 |
X | X的阴离子核外电子云均呈球形 |
Y | 原子的最高能级上有3个未成对电子,其最简单气态氢化物在水中的溶解度在同族元素所形成的最简单气态氢化物中最大 |
Z | 基态原子核外有3个能级填充了电子,能量最高能级的电子数等于前两个能级的电子数之和 |
R | 元素原子的最外层电子排布式为nsn-1npn-1 |
T | 一种核素的质量数为65,中子数为36 |
根据上述元素信息,回答下列问题。
(1)基态T2+的电子排布式为__。
(2)Y、Z、R的电负性由大到小的顺序为__(用元素符号表示)。
(3)YX4+的空间构型为__,离子中![]() 原子的杂化轨道类型为___,YX4+的电子式为__。
原子的杂化轨道类型为___,YX4+的电子式为__。
(4)YX3的一种等电子体分子是__,YX3的键角大于X2Z的键角的主要原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钛镁合金是制造高性能飞机的重要材料。金属钛、镁均采用六方最密堆积,下列说法正确的是_____(填序号)。
A.钛镁合金用于制造高性能飞机主要是由于它们的价格昂贵,制造出的飞机能卖好价钱
B.钛、镁金属晶体中,其配位数均为12
C.金属钛的熔点(1668℃)很高,与金属键无关
(2)钙钛型复合氧化物可用于制造航母中的热敏传感器,其晶胞结构如图所示,其中A为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有很好的电学性能。下列说法正确的是______(填序号)。
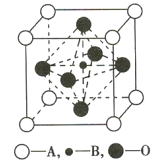
A.金属Ca、Sr、Ba采用体心立方密堆积
B.用A、B、O表示的钙钛型复合氧化物晶体的化学式可表示为ABO3
C.在制造Fe薄片时,金属键完全断裂
D.V、Cr、Mn、Fe晶体中均存在金属阳离子和阴离子
(3)辽宁号航母飞行甲板等都是由铁及其合金制造的。铁有![]() 三种同素异形体,其晶胞结构如图所示。
三种同素异形体,其晶胞结构如图所示。
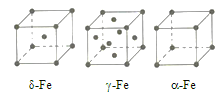
①![]() 晶胞中含有的铁原子数为___________。
晶胞中含有的铁原子数为___________。
②![]() 、
、![]() 两种晶体中铁原子的配位数之比为___________。
两种晶体中铁原子的配位数之比为___________。
③若![]() 晶胞的边长为a cm,
晶胞的边长为a cm, ![]() 晶胞的边长为b cm,则两种晶体的密度之比为___________。
晶胞的边长为b cm,则两种晶体的密度之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对温室气体二氧化碳的研究一直是科技界关注的重点。
Ⅰ.在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一,相关反应如下:
主反应:CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH1①
副反应:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
已知:H2和CH4的燃烧热分别为285.5 kJ·mol-1和890.0 kJ·mol-1,H2O(l)===H2O(g) ΔH=+44 kJ·mol-1。
(1)ΔH1=________ kJ·mol-1。
(2)有利于提高CH4产率的反应条件是(至少写两条)______________________________工业上提高甲烷反应选择性的关键因素是________________________________。
(3)T℃时,若在体积恒为2 L的密闭容器中同时发生上述反应,将物质的量之和为5 mol的H2和CO2以不同的投料比进行反应,结果如图1所示。若a、b表示反应物的平衡转化率,则表示H2平衡转化率的是________,c、d分别表示CH4(g)和CO(g)的体积分数,由图1可知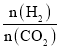 =________时,甲烷产率最高。若该条件下CO的产率趋于0,则T℃时①的平衡常数K=___________________。
=________时,甲烷产率最高。若该条件下CO的产率趋于0,则T℃时①的平衡常数K=___________________。
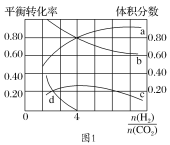
Ⅱ.溶于海水的CO2 95%以HCO3-形式存在。
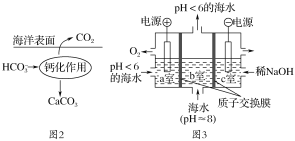
在海洋中,通过图2钙化作用实现碳自净。
(4)写出钙化作用的离子方程式________________。
(5)电解完成后,a室的pH________(填“变大”、“变小”或“几乎不变”);b室发生反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种新型热激活电池的结构如图所示,电极a的材料是氧化石墨烯(CP)和铂纳米粒子,电极b的材料是聚苯胺(PANI),电解质溶液中含有Fe3+和Fe2+。加热使电池工作时电极b发生的反应是PANI-2e-=PANIO(氧化态聚苯胺,绝缘体)+2H+,电池冷却时Fe2+在电极b表面与PANIO反应可使电池再生。下列说法不正确的是
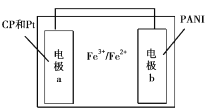
A.电池工作时电极a为正极,且发生的反应是:Fe3++e-—Fe2+
B.电池工作时,若在电极b周围滴加几滴紫色石蕊试液,电极b周围慢慢变红
C.电池冷却时,若该装置正负极间接有电流表或检流计,指针会发生偏转
D.电池冷却过程中发生的反应是:2Fe2++PANIO+2H+=2Fe3++ PANI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,由于石油价格的不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以煤为原料生产聚乙烯(PVC)和人造羊毛的合成线路。
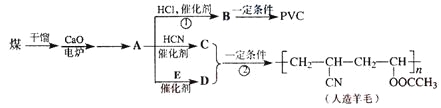
请回答下列问题:
(1)写出反应类型:反应①______________,反应②__________________。
(2)写出结构简式:PVC________________,C______________________。
(3)写出A![]() D的化学方程式_______________________________。
D的化学方程式_______________________________。
(4)与D互为同分异构体且可发生碱性水解的物质有________种(不包括环状化合物),写出其中一种的结构简式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。
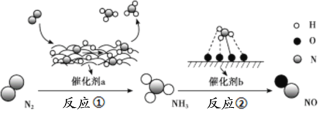
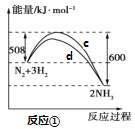
下列分析合理的是
A.如图中c曲线是加入催化剂a时的能量变化曲线
B.反应①的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92 kJ/mol
2NH3(g) ΔH=-92 kJ/mol
C.在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L
D.催化剂a、b能提高化学反应①、②的化学反应速率和平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com