
| A. | 0.1mol•L-1Na2CO3溶液中,c(OH)-=c(H+)+c(HCO3-)+c(H2CO3) | |
| B. | 相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则对于同温、同体积、同pH的HCN和HClO分别与Na0H恰好完全反应时,消耗NaOH的物质的量:HClO<HCN | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到酸性的混合溶液:c(Na+)>c(CH3COO-)>C(H+)>c(OH-) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-)+c(Cl-) |
分析 A.0.1mol•L-1Na2CO3溶液中存在质子守恒,水电离出的氢离子浓度和氢氧根离子浓度相同,但碳酸根离子结合水电离出的氢离子形成弱电解质,溶液中氢氧根离子浓度等于溶液中所有氢离子的存在形式总和;
B.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,说明CN-水解程度大于ClO-,证明HCN酸性小于HClO,同温、同体积、同pH的HCN和HClO溶液,HCN溶液浓度大于HClO的浓度;
C.依据溶液中电荷守恒分析判断离子浓度大小;
D.pH=5的混合溶液,钠离子、硝酸根离子不电离、不水解.
解答 解:A.根据质子守恒:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故A错误;
B.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,说明CN-水解程度大于ClO-,证明HCN酸性小于HClO,同温、同体积、同pH的HCN和HClO溶液,HCN溶液浓度大于HClO的浓度,消耗NaOH的物质的量HCN溶液消耗的多,故B正确;
C.向醋酸钠溶液中加入适量醋酸,得到酸性的混合溶液,溶液中c(H+)>c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(Na+)<c(CH3COO-),故C错误;
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中,离子不发生水解,c(Na+)=c(NO3-),故D错误;
故选B.
点评 本题考查了离子浓度大小的比较,明确盐类水解的应用及质子守恒、电荷守恒即可解答,注意选项D为易错点,题目难度中等.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:解答题
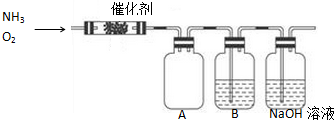
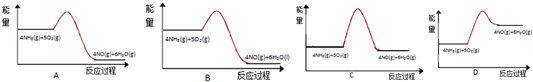
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
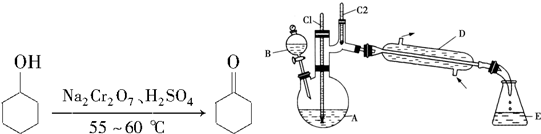
| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.962 4 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.947 8 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.330 1 | |
| 水 | 100.0 | 0.998 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.2mol/L CaCl2溶液中含Cl-数为0.2×6.02×1023 | |
| B. | 22gCO2含有0.5mol CO2分子,体积为11.2L | |
| C. | 3.01×1023个水分子的摩尔质量为9g/mol | |
| D. | 3.2g O2和3.2g O3含氧原子的数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaClO溶液通入少量SO2气体:3ClO-+SO2+H2O=SO${\;}_{4}^{2-}$+Cl-+2HCl | |
| B. | 将过量的Cl2通入FeBr2中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | |
| C. | 向碳酸氢钙溶液滴加氢氧化钠溶液至Ca2+恰好完全沉淀:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至沉淀量最大:NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知制备甲醇的有关化学反应及平衡常数如表所示:
已知制备甲醇的有关化学反应及平衡常数如表所示:| 化学反应 | 反应热 | 平衡常数(850℃) |
| ①CO2 (g)+3H2 (g)═CH3OH(g)+H2O(g) | △H1=-48.8 kJ•molˉ1 | K1=320 |
| ②CO(g)+H2O(g)═H2(g)+CO2(g) | △H2=-41.2 kJ•molˉ1 | K2 |
| ③CO(g)+2H2(g)═CH3OH(g) | △H3 | K3=160 |
| 物质 | H2 | CO2 | CH3OH | H2O |
| 浓度(mol•Lˉ1) | 0.2 | 0.2 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率:乙>甲 | |
| B. | 平衡混合物中SO2的体积分数:乙>甲 | |
| C. | SO2的转化率:乙>甲 | |
| D. | 平衡时O2的体积分数:甲>乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com