
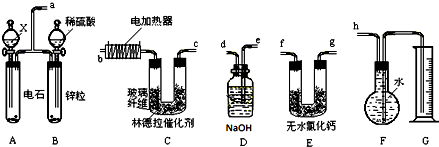
分析 (1)根据实验的目的是用乙炔和氢气之间的反应来制取乙烯,根据装置的特点和应用来连接实验装置;
(2)碳化钙可以和水反应得到乙炔气体,乙炔气体和氢气在催化剂的作用下反应得到乙烯;
(3)为减慢反应速率,可以将水换成饱和食盐水;
(4)根据发生的反应结合实验实际情况来确定存在的杂质气体;
(5)根据反应:CaC2+2H2O→HC≡CH↑+Ca(OH)2、HC≡CH+H2$\stackrel{林德拉催化剂}{→}$CH2=CH2结合乙炔氢化的转化率等于反应的乙炔和全部的乙炔的量的比值来计算.
解答 解:(1)实验装置显示制取乙炔和氢气,然后将二者混合,但是乙炔、氢气中含有杂质气体,应该先将杂质气体除去,再将之干燥,是纯净的气体在催化剂的作用下发生反应得到乙烯,乙烯是难溶于水的气体,可以采用排水法收集,所以装置的连接顺序是:a、e、d、f、g、b、c、h(f、g可调换),
故答案为:a、e、d、f、g、b、c、h(f、g可调换);
(2)A中是碳化钙和水反应制取乙炔的过程,C中是乙炔和氢气之间的加成反应,方程式分别为:CaC2+2H2O→HC≡CH↑+Ca(OH)2、HC≡CH+H2$\stackrel{林德拉催化剂}{→}$CH2=CH2,
故答案为:CaC2+2H2O→HC≡CH↑+Ca(OH)2、HC≡CH+H2$\stackrel{林德拉催化剂}{→}$CH2=CH2;
(3)碳化钙和水之间的反应十分剧烈,为减慢反应速率,可以将水换成饱和食盐水,故答案为:饱和食盐水;
(4)F中留下的气体除含少许空气外,还有没有完全消耗的乙炔,氢气以及生成的乙烯等气体,故答案为:H2、C2H4、C2H2;
(5)0.020molCaC2的电石,和水反应得到乙炔的物质的量是0.02mol,1.60g含杂质18.7%的锌粒(杂质不与酸反应)的物质的量是:$\frac{1.6(1-18.7%)}{65}$mol=0.02mol,和硫酸反应,产生的氢气的物质的量是0.005mol,状况下测得G中收集到的水VmL,V=672mL,则得到的乙烯的物质的量是$\frac{0.672L}{22.4L/mol}$=0.03mol,
设乙炔的转化量是x,则HC≡CH+H2$\stackrel{林德拉催化剂}{→}$CH2=CH2
1 1 1
x x x
则反应后得到气体的物质的量(0.02-x)+(0.02-x)+x=0.03,解得X=0.01mol,所以乙炔氢化的转化率为$\frac{0.01mol}{0.02mol}$×100%=50%,
故答案为:50%.
点评 本题考查性质实验及含量测定,为高频考点,把握物质的性质、实验装置的作用及发生的反应等为解答的关键,侧重分析与实验、计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
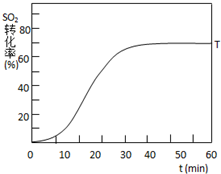 根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.
根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
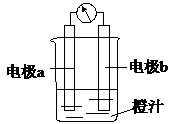 课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论不正确的是( )
课堂学习中,同学们利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论不正确的是( )| A. | 原电池是将化学能转化成电能的装置 | |
| B. | 原电池由电极、电解质溶液和导线等组成 | |
| C. | 右图中a极为镁条、b极为锌片时,导线中会产生电流 | |
| D. | 右图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
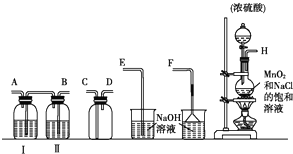
| 实验步骤 | 预期现象和结论 | |
| ① | 取少量上述漂白粉于试管中,加入适量1mol/L盐酸溶解后,再将产生的气体导入澄清石灰水中. | (1)若澄清石灰水未见浑浊,则假设1成立; (2)若澄清石灰水变浑浊,则假设2或3成立. |
| ② | 向步骤①反应后的试管中滴入1~2滴品红溶液,振荡(或另外取样操作) | 结合实验①中的(2), (1)若品红褪色,则假设3成立; (2)若品红不褪色,则假设2成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
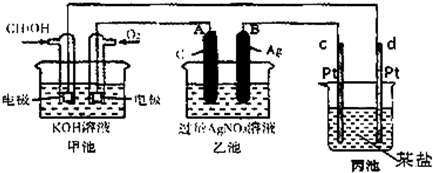
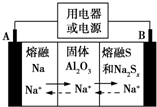 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 放电时,电极A为负极,Na+由B向A移动 | |
| B. | 放电时,负极反应式为2Na-xe-═2Na+ | |
| C. | 充电时,电极B的反应式为S2--2e-═xS | |
| D. | 充电时,电极B接电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氧化反应与化合反应属于并列关系 | B. | 单质与化合物属于交叉关系 | ||
| C. | 化合物与氧化物属于包含关系 | D. | 纯净物与混合物属于包含关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com