
(14分)按要求回答下列问题:
(1)石墨晶体中C-C键的键角为 _____。其中平均每个六边形所含的C原子数为 个。
(2)金刚石晶体中含有共价键形成的C原子环,其中最小的C环上有 个C原子。
(3)CsCl晶体中每个Cs+周围有 个Cl-,每个Cs+周围与它最近且距离相等的Cs+共有 个。
(4)白磷分子中的键角为 ,分子的空间结构为 ,每个P原子与 个P原子结合成共价键。若将1分子白磷中的所有P-P键打开并各插入一个氧原子,共可结合 个氧原子, 若每个P原子上的孤对电子再与氧原子配位,就可以得到磷的另一种氧化物 (填分子式)。
(5)二氧化硅是一种 晶体,每个硅原子周围有 个氧原子。
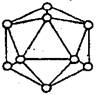
(6) 晶体硼的基本结构单元是由硼原子组成的正二十面体的原子晶体。其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,试观察图形回答:这个基本结构单元由_____个硼原子组成,共含有________个B-B键。
(1)120°; 2。 (2)6 (3)8; 6
(每空1分) (4)60°; 正四面体; 3; 6; P4O10。
(5)原子; 4。 (6)12; 30。
【解析】考查常见的晶体结构类型。
(1)石墨是层状结构,石墨晶体中C-C键的键角为120°。由于每个碳原子被3个正六边形共用,所以平均每个六边形所含的C原子数为6×1/3=2个。
(2)金刚石晶体中最小的C环上有6个碳原子。
(3)氯化铯晶体的配位数是8,所以CsCl晶体中每个Cs+周围有8个Cl-,每个Cs+周围与它最近且距离相等的Cs+共有6个,即上下、前后、左右个一个。
(4)白磷是正四面体型结构,键角是60°。每个P原子与3个P原子结合成共价键。由于分子中共有6个P-P键,所以需要插入6个氧原子。若每个P原子上的孤对电子再与氧原子配位,则又可以结合4个氧原子,所以化学式为P4O10。
(5)二氧化硅是一种原子晶体,由于每个硅原子钠形成4和Si-O键,所以每个硅原子周围有4个氧原子。
(6)根据结构可知,每个B原子被5个相邻的三角形共用,所以含有的B原子是3×1/5×20=12。每个B-B键被2个相邻的三角形共用,所以含有的B-B键是3×1/2×20=30。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化关系如图所示(部分产物已略去).
A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化关系如图所示(部分产物已略去).| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH- H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH-查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com