
·ÖĪö £Ø1£©¢ŁŅĄ¾ŻČÜŅŗĻ”ŹĶ¹ż³ĢÖŠĖłŗ¬ČÜÖŹµÄĪļÖŹµÄĮæ²»±ä¼ĘĖćŠčŅŖÅØĮņĖįµÄĢå»ż£»
¢ŚŌŚ²Ł×÷֊ƻӊ°ŃÉŁĮæĻ“µÓÉÕ±µÄĻ“µÓŅŗČ«²æ×ŖŅʵ½ČŻĮæĘæÖŠ£¬µ¼ÖĀ²æ·ÖČÜÖŹĖšŗÄ£¬ČÜÖŹµÄĪļÖŹµÄĮæĘ«Š”£¬ŅĄ¾ŻC=$\frac{n}{V}$½ųŠŠĪó²ī·ÖĪö£»
¢ŪČōĮæČ”ÅØČÜŅŗŹ±ø©ŹÓĮæĶ²£¬ŌņĮæČ”µÄÅØĮņĖįĢå»żĘ«Š”£¬ŅĄ¾ŻC=$\frac{n}{V}$½ųŠŠĪó²ī·ÖĪö£»
£Ø2£©øł¾Żn=$\frac{n}{M}$æÉÖŖ£¬µČÖŹĮæµÄO2ŗĶO3£¬ĖüĆĒµÄĪļÖŹµÄĮæÖ®±ČÓėĦ¶ūÖŹĮæ³É·“±Č£»øł¾ŻN=nNAæÉÖŖ£¬·Ö×ÓŹżÄæÖ®±ČµČÓŚĪļÖŹµÄĮæÖ®±Č£»O2ŗĶO3¾łÓÉOŌ×Ó¹¹³É£¬¶žÖŹĮæĻąµČ£¬ŗ¬ÓŠŃõŌ×ÓŹżÄæĻąµČ£»ĻąĶ¬Ģõ¼žĻĀ£¬Ģå»żÖ®±ČµČÓŚĪļÖŹµÄĮæÖ®±Č£®
½ā“š ½ā£ŗ£Ø1£©¢ŁÓĆ18.00mol•L-1µÄÅØĮņĖįÅäÖĘ2.00mol•L-1µÄĻ”ĮņĖį100mL£¬ÉčŠčŅŖÅØĮņĖįĢå»żĪŖV£¬ŌņŅĄ¾ŻČÜŅŗĻ”ŹĶ¹ż³ĢÖŠĖłŗ¬ČÜÖŹµÄĪļÖŹµÄĮæ²»±äµĆ£ŗV”Į18mol/L=2.0mol/L”Į100mL£¬½āµĆV=11.1mL£»
¹Ź“š°øĪŖ£ŗ11.1£»
¢ŚŌŚ²Ł×÷֊ƻӊ°ŃÉŁĮæĻ“µÓÉÕ±µÄĻ“µÓŅŗČ«²æ×ŖŅʵ½ČŻĮæĘæÖŠ£¬µ¼ÖĀ²æ·ÖČÜÖŹĖšŗÄ£¬ČÜÖŹµÄĪļÖŹµÄĮæĘ«Š”£¬ŅĄ¾ŻC=$\frac{n}{V}$æÉÖŖČÜŅŗÅضČĘ«µĶ£»
¹Ź“š°øĪŖ£ŗĘ«µĶ£»
¢ŪČōĮæČ”ÅØČÜŅŗŹ±ø©ŹÓĮæĶ²£¬ŌņĮæČ”µÄÅØĮņĖįĢå»żĘ«Š”£¬ĮņĖįµÄĪļÖŹµÄĮæĘ«Š”£¬ŅĄ¾ŻC=$\frac{n}{V}$æÉÖŖČÜŅŗÅضČĘ«µĶ£»
¹Ź“š°øĪŖ£ŗĘ«µĶ£»
£Ø2£©øł¾Żn=$\frac{m}{M}$æÉÖŖ£¬µČÖŹĮæµÄO2ŗĶO3£¬ĖüĆĒµÄĪļÖŹµÄĮæÖ®±Č=48g/mol£ŗ32g/mol=3£ŗ2£»
øł¾ŻN=nNAæÉÖŖ£¬O2ŗĶO3Ėłŗ¬·Ö×ÓŹżÄæÖ®±Č=O2ŗĶO3ĪļÖŹµÄĮæÖ®±Č=3£ŗ2£»
O2ŗĶO3¾łÓÉOŌ×Ó¹¹³É£¬¶žÖŹĮæĻąµČ£¬ŗ¬ÓŠŃõŌ×ÓŹżÄæĻąµČ£¬¼“ŗ¬ÓŠŃõŌ×ÓŹżÄæÖ®±ČĪŖ1£ŗ1£»
ĻąĶ¬Ģõ¼žĻĀ£¬O2ŗĶO3Ģå»żÖ®±ČµČÓŚO2ŗĶO3µÄĪļÖŹµÄĮæÖ®±Č=3£ŗ2£¬
¹Ź“š°øĪŖ£ŗ3£ŗ2£»1£ŗ1£»3£ŗ2£®
µćĘĄ ±¾Ģāæ¼²éĮĖŅ»¶ØĪļÖŹµÄĮæÅضČČÜŅŗµÄÅäÖĘ£¬ĪļÖŹµÄĮæÓŠ¹Ų¼ĘĖć£¬Ć÷Č·ÅäÖĘ¹ż³Ģ¼°²Ł×÷²½Öč”¢Ć÷Č·ÓŠ¹ŲĪļÖŹµÄĮæ¼ĘĖćµÄ¹«Ź½ŹĒ½āĢā¹Ų¼ü£¬ĢāÄæÄŃ¶Č²»“ó£®


 ¾ŁŅ»·“ČżĶ¬²½Ēɽ²¾«Į·ĻµĮŠ“š°ø
¾ŁŅ»·“ČżĶ¬²½Ēɽ²¾«Į·ĻµĮŠ“š°ø æŚĖćÓėÓ¦ÓĆĢāæØĻµĮŠ“š°ø
æŚĖćÓėÓ¦ÓĆĢāæØĻµĮŠ“š°ø ĆūŹ¦µć¾¦×Ö“Ź¾ä¶ĪĘŖĻµĮŠ“š°ø
ĆūŹ¦µć¾¦×Ö“Ź¾ä¶ĪĘŖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğ½Ī÷Ź”ø߶žÉĻµŚŅ»“ĪŌĀæ¼»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĖįŌŚČܼĮÖŠµÄµēĄėŹµÖŹŹĒĖįÖŠµÄH+×ŖŅĘøųČܼĮ·Ö×Ó£¬ČēHCl + H2O = H3O+ + Cl£”£ŅŃÖŖH2SO4ŗĶHNO3ŌŚ±ł“×ĖįÖŠµÄµēĄėĘ½ŗā³£ŹżKa1(H2SO4) = 6.3 ”Į 10£9 £¬Ka(HNO3) = 4.2 ”Į 10£10”£ ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®±ł“×ĖįÖŠH2SO4µÄµēĄė·½³ĢŹ½£ŗH2SO4 + 2CH3COOH = SO42£+ 2CH3COOH2+
B£®H2SO4µÄ±ł“×ĖįČÜŅŗÖŠ£ŗc(CH3COOH2+) = c(HSO4£)+ 2c(SO42£) + c(CH3COO£)
C£®ÅØ¶Č¾łĪŖ0.1mol”¤L£1µÄH2SO4»ņHNO3µÄ±ł“×ĖįČÜŅŗ£ŗpH(H2SO4)£¾ pH(HNO3)
pH(HNO3)
D£®ĻņHNO3µÄ±ł“×ĖįČÜŅŗÖŠ¼ÓČė±ł“×Ėį£¬c(CH3COOH2+)/c(HNO3)¼õŠ”
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
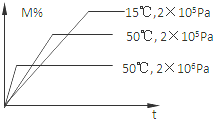 ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦£ŗM£Øg£©+N£Øg£©?R£Øg£©+2L£¬“Ė·“Ó¦·ūŗĻĻĀĶ¼¹ŲĻµ£¬øĆ·“Ó¦ŹĒĻĀĮŠÄÄÖÖĒéæö£Ø””””£©
ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦£ŗM£Øg£©+N£Øg£©?R£Øg£©+2L£¬“Ė·“Ó¦·ūŗĻĻĀĶ¼¹ŲĻµ£¬øĆ·“Ó¦ŹĒĻĀĮŠÄÄÖÖĒéæö£Ø””””£©| A£® | Õż·“Ó¦ĪüČČ£¬LŹĒ¹ĢĢå»ņŅŗĢå | B£® | Õż·“Ó¦ĪüČČ£¬LŹĒĘųĢå | ||
| C£® | Õż·“Ó¦·ÅČČ£¬LŹĒ¹ĢĢå»ņŅŗĢå | D£® | Õż·“Ó¦·ÅČČ£¬LŹĒĘųĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
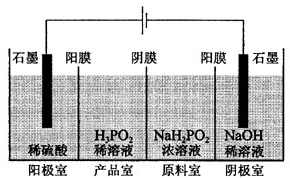 “ĪĮ×Ėį£ØH3PO2£©ŹĒŅ»ÖÖ¾«ĻøĮ׻ƹ¤²śĘ·£¬¾ßÓŠ½ĻĒ滹ŌŠŌ£®»Ų“šĻĀĮŠĪŹĢā£ŗ
“ĪĮ×Ėį£ØH3PO2£©ŹĒŅ»ÖÖ¾«ĻøĮ׻ƹ¤²śĘ·£¬¾ßÓŠ½ĻĒ滹ŌŠŌ£®»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĆæŅ»øö·“Ó¦£¬ŌŚŅ»øöĪĀ¶ČĻĀ£¬ÓŠŅ»øöKÖµ | |
| B£® | KŌ½“󣬱ķŹ¾ÕżĻņ·“Ó¦µÄĒćĻņ“󣬷“Ó¦ĶźČ« | |
| C£® | KÖµÖ»ÄÜĖµĆ÷·“Ó¦µÄ×ī“óĻŽ¶Č£¬²»ÄÜĖµĆ÷·“Ó¦µÄĖŁ¶Č | |
| D£® | ĪüČČ·“Ó¦µÄKÖµ“óÓŚĖłÓŠ·ÅČČ·“Ó¦µÄKÖµ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ź¹ÓĆŗĻŹŹµÄ“߻ƼĮæÉ“ó“óĢįøßÉś²śŠ§ĀŹ | |
| B£® | ÓÉ·“Ó¦ŠčŌŚ300”ę½ųŠŠ£¬æÉÖŖøĆ·“Ó¦ŹĒĪüČČ·“Ó¦ | |
| C£® | Ōö“óŌĮĻĘųÖŠCO2µÄ°Ł·Öŗ¬Į棬æÉŅŌĢįøßH2µÄ×Ŗ»ÆĀŹ | |
| D£® | 70MPaµÄŃ¹Į¦£¬²»½öæÉŅŌŌö¼Óµ„Ī»Ź±¼äÄŚµÄ²ś³ö£¬»¹æÉŅŌĢįøßCO2ŗĶH2µÄĄūÓĆĀŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
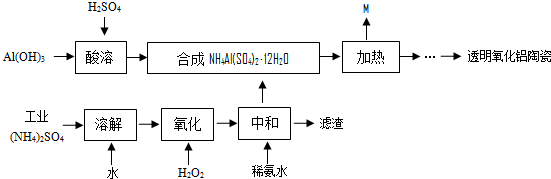
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com