
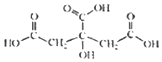
 柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )
柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )| A. | 柠檬酸的分子式是C6H8O7 | |
| B. | 柠檬酸是易溶于水的有机物 | |
| C. | 1mol柠檬酸足量的钠反应生成2.0mol的氢气 | |
| D. | 柠檬酸只能发生取代反应 |
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
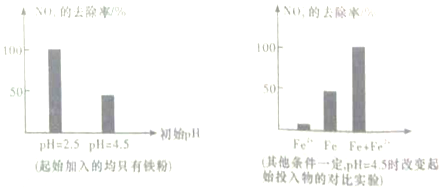
| A. | pH=4.5时,NO3-的去除率低,其原因可能是FeO(OH) 不导电,阻碍电子转移 | |
| B. | 通过对比试验发现,在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率,可能原因是Fe2+将NO3-直接还原了 | |
| C. | 加入Fe2+可能发生的反应是Fe2++2FeO(OH)═Fe3O4+2H+ | |
| D. | 由图猜测,溶液中H+浓度越大,对NO3-的去除率越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
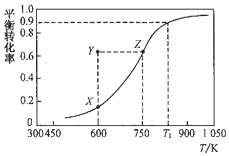 甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在IL 的密闭容器中进行).下列有关说法正确的是( )
甲醇脱氢可制取甲醛:CH3OH(g)?HCHO(g)+H2(g),甲醇的平衡转化率随温度变化的曲线如图所示(已知反应在IL 的密闭容器中进行).下列有关说法正确的是( )| A. | 平衡常数:K600K>K750K | |
| B. | 从Y到Z点可通过增大压强实现 | |
| C. | 在Tl点K时,该反应的平衡常数为8.1 | |
| D. | 若工业上利用此反应进行生产,为了提高经济效益将反应温度升高至1050K以上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | 电离常数 | 弱酸 | 电离常数 |
| H2CO3 | Ka1=4.4×10-7 | H2C2O4 | Ka1=5.4×10-2 |
| Ka2=4.7×10-11 | Ka2=5.4×10-5 |
| A. | 2 | B. | 4 | C. | 6 | D. | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时立即用沙子盖灭 | |
| B. | 制取有毒气体时需在通风橱中进行 | |
| C. | 将过期的化学药品直接倒入下水道 | |
| D. | 给试管中液体加热时试管口要避开人 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al 的第一电离能逐渐增大 | B. | O、F、N 的电负性逐渐增大 | ||
| C. | S2-、Cl-、K+的半径逐渐增大 | D. | 热稳定性:HF>H2O>NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com