
| A. | 酸式滴定管在装酸液前未用待装液润洗2~3次,使测定结果偏大 | |
| B. | 滴定终点时,俯视读数,使测定结果偏小 | |
| C. | 只能选用酚酞作指示剂 | |
| D. | 滴入最后一滴NaOH溶液,溶液突然变色,即为滴定终点 |
分析 A.根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
B.根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
C.NaOH和HCl恰好反应溶液呈中性,可以选择酸性或碱性变色范围内的指示剂;
D.待测液变色点不是滴定终点.
解答 解:A.酸式滴定管在装酸液前未用待装液润洗2~3次,待装液被稀释,使得HCl的物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,使测定结果偏小,故A错误;
B.滴定终点时,俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,使测定结果偏小,故B正确;
C.NaOH和HCl恰好反应溶液呈中性,可以选择酚酞或甲基橙为指示剂,故C错误;
D.滴定时,当滴至待测液变色且半分钟不恢复即为滴定终点,故D错误;
故选B.
点评 本题为考查中和滴定实验,把握中和滴定原理、误差分析为解答的关键,注重分析与实验能力的结合,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大C的量,H2O的转化率增大 | |
| B. | 减小容器体积,正、逆反应速率均减小 | |
| C. | 加入催化剂,平衡常数不变 | |
| D. | 升高温度,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
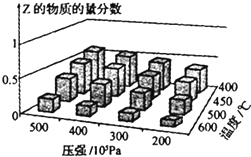 为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )
为探究外界条件对反应:mA(g)+nB(g)?cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数.实验结果如图所示,下列判断正确的是( )| A. | △H>0 | |
| B. | 升温,正、逆反应速率都增大,平衡常数减小 | |
| C. | 增大压强,Z的含量减小 | |
| D. | 在恒温恒容下,向已达到平衡的体系中加入少量Z,达到平衡后Z的含量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沙子硬度大,来源丰富,性质稳定,可用作混凝土中的填充材料 | |
| B. | 可用过量氨水除去MgCl2溶液中的AlCl3 | |
| C. | 工业上可用硫酸制化肥、农药、染料等 | |
| D. | 在煤中加入一些生石灰可以减少燃煤产生的二氧化硫的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
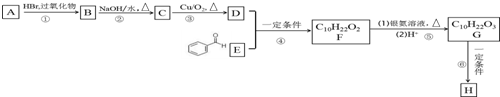
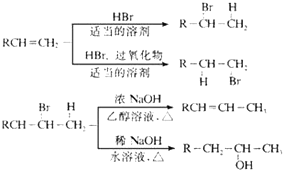
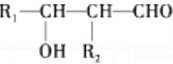
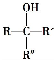 不能被氧化成醛或酮;
不能被氧化成醛或酮;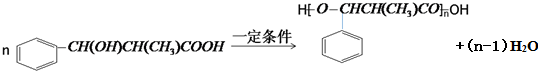
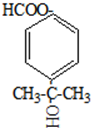 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com