
【题目】核外电子数相等的两个原子,它们之间的关系是( )
A.质量数一定相等B.互称为同位素
C.一定是同种原子D.分别组成的单质,物理性质一定相同
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】请根据物质在生产、生活等方面的应用填空。
(1)厨房里常使用小苏打,向其水溶液中滴加酚酞溶液后,溶液呈__________(填字母代号)。
a.浅蓝色 b.浅红色 c.浅绿色
(2)检验某补铁剂中的Fe2+是否被氧化成Fe3+,可用__________溶液(填字母代号)。
a.NaOH b.H2O2 c.KSCN
(3)电解氧化铝时加入冰晶石的作用为________________。
(4)完成乙醇发生催化氧化的化学方程式:2CH3CH2OH+O2![]() _________________________。
_________________________。
(5)常见的酸性锌锰电池的负极材料为Zn,请写出负极的电极反应式:___________________。
(6)铝热反应是工业上常用的反应之一,请写出Al与Fe3O4发生铝热反应的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图某学校实验室从化学试剂商店买回的硝酸试剂标签上的部分内容。

据此下列说法错误的是( )
A. 配制250.0mL 0.57mol·L-1的稀硝酸用酸式滴定管量取该硝酸12.5mL
B. 该硝酸与等体积的水混合所得溶液的质量分数大于31.5%
C. 该硝酸试剂的物质的量浓度为11.4mol·L-1
D. 常温下,将2.7gAl投入足量该硝酸中不能得到标准状况下的氢气3.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据元素周期律,下列推断正确的是( )
A. 酸性:H2SiO3>H2CO3 B. 热稳定性:H2S>H2O
C. 碱性:KOH>Ca(OH)2 D. 若离子半径:R2﹣>M+,则原子序数:R>M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答:
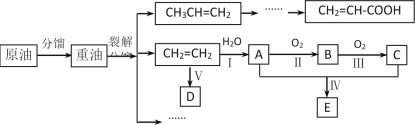
已知:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
(1)上述路线中裂解属于____变化(填“物理”或“化学”)。反应I的反应类型____。
CH2=CH-COOH中官能团的名称_____。D为高分子化合物,可以用来制造多种包装材料。CH3CH=CH2也可以发生类似反应V的反应,其产物结构简式是___。
(2)写出反应II的化学方程式____。
(3)E是有香味的物质,在实验室中可用如图装置制取。
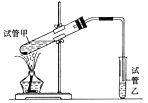
①试管乙中所盛装的试剂为_____。
②反应IV的化学方程式是_____。若要把制得的产物分离出来,应采用的实验操作是____。
(4)根据乙烯和乙酸的结构及性质进行类比,关于有机物CH2=CH-COOH的说法正确的是___。
A.与CH3COOH互为同系物
B.可以与NaHCO3溶液反应放出CO2气体
C.在一定条件下可以发生酯化、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如下图所示,下列说法不正确的是
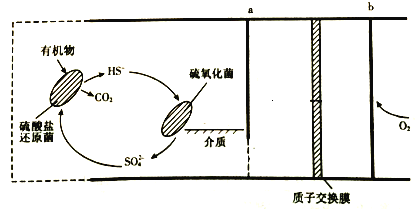
A. 该电池在高温下工作的速度更快
B. HS-在硫氧化菌作用下转化为SO42-的反应是:HS-+4H2O-8e-= SO42-+9H+
C. b是电池的负极
D. 若该电池有0.45 mol 电子转移,则有0.45 mol H+向左通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在人们的生活经常出现
(1)汽车尾气中NO生成过程的能量变化示意图如下:

该条件下,1mol N2和1molO2完全反应生成NO,会_______________(填“吸收”或“放出”)________kJ能量。
(2)一定温度下,在体积为0.5 L的恒容密闭容器中,氮的气态氧化物X和Y之间反应过程中各物质的物质的量与时间的关系如图所示。

①该反应的化学反应方程式:______________________。
②在0~3 min内,用Y表示的反应速率为____________。
③下列叙述能说明该反应已达到化学平衡状态的是________(填字母)。
a.容器内压强不再发生变化
b.X的体积分数不再发生变化
c.容器内原子总数不再发生变化
d.相同时间内消耗nmolY的同时生成2nmol X
④反应达到平衡后,若降低温度,则υ(正)______,υ(逆)________。(填“增大”“减小”或“不变”)。
(3)反应 A(g)+3B(g)═2C(g)+3D(g)在四种不同情况下的反应速率分别为:
①υ (A)=0.015mol (Ls)﹣1 ②υ (B)=0.09mol (Ls)﹣1
③υ (C)=2.4mol (Lmin )﹣1 ④υ (D)=0.045mol (Ls)﹣1
该反应在四种不同情况下速率由大到小的顺序为(用序号填空)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β—紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。(已知醛基能与H2加成)

下列说法正确的是
A. β—紫罗兰酮可使酸性KMnO4溶液褪色
B. 1mol中间体X最多能与2molH2发生加成反应
C. 维生素A1易溶于NaOH溶液
D. β—紫罗兰酮与中间体X互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com