
| A、向某浓度的醋酸钠溶液滴入几滴酚酞试液:溶液由无色变为浅红色 |
| B、向滴有甲基橙试液的醋酸溶液加入少量醋酸钠晶体:振荡后溶液由红色变为橙色 |
| C、通过对比不同浓度的导电实验:醋酸溶液的导电性较盐酸溶液的导电性弱 |
| D、取相同体积pH=1的盐酸和醋酸溶液,分别加入足量的锌,用排水法收集生成的氢气:相同条件下,醋酸生成的氢气体积大 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| c(Cl-) |
| c(ClO-) |
A、若某温度下,反应后C(Cl-):C(ClO-)=11,则溶液中C(ClO-):C(ClO3-)=
| ||||
B、参加反应的氯气的物质的量等于
| ||||
C、改变温度,反应中转移电子的物质的量n的范围:
| ||||
D、改变温度,产物中KC1O3的最大理论产量为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| n(CIO-) | ||
n(CI
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
| A、等物质的量浓度的各溶液pH关系为:pH(NaClO)>pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa) |
| B、向NaClO溶液中通入少量CO2气体反应为:ClO-+H2O+CO2=HClO+HCO3- |
| C、等物质的量浓度的HClO稀溶液与NaOH稀溶液等体积混合后溶液中:c(Na+)>c(ClO-)>c(OH-)>c(H+) |
| D、Na2CO3和NaHCO3混合液中,一定有:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 |
| 氢气体积(mL) | 50 | 120 | 224 | 392 | 472 | 502 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生用0.1000mol?L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为以下几步:
某学生用0.1000mol?L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为以下几步:| 滴定次数 | 待测溶液的体积(/mL) | 标准NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入5mL盐酸进行滴定 |
| B、返滴一滴待测盐酸 |
| C、重新进行滴定 |
| D、以上方法均不适用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
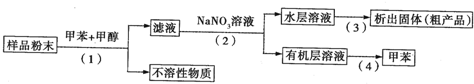
| A、步骤(1)需要过滤装置 |
| B、活性物质易溶于有机溶剂,难溶于水 |
| C、步骤(3)需要用到蒸发皿 |
| D、步骤(4)是利用物质的沸点差异进行分离的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①稀盐酸溶液 |
| ②50mL0.11mol/的过量草酸铵溶 |
| ③过滤 |
| ④加酸溶液 |
| ⑤用标准高锰 |
| 酸钾溶液滴定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com