
【题目】在无色透明强酸性溶液中,能大量共存的离子组是( )
A.K+、Cu2+、NO3﹣、SO42﹣
B.K+、Na+、Cl﹣、CO32﹣
C.Zn2+、NH4+、NO3﹣、Cl﹣
D.K+、Na+、MnO4﹣、SO42﹣
科目:高中化学 来源: 题型:
【题目】Ⅰ.CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH 2=b kJ/mol
CO2(g)+H2(g) ΔH 2=b kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH 3=c kJ/mol
2CO2(g) ΔH 3=c kJ/mol
(1)求反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
2CO(g)+2H2(g) ΔH =______kJ/mol(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为_______________。
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2Sx )分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
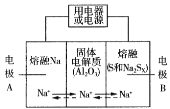
Na2Sx ![]() 2Na+xS (3<x<5)
2Na+xS (3<x<5)
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
(3)根据上表数据,判断该电池工作的适宜温度应为______________(填字母序号)。
A.100℃以下 B.100℃~300℃
C.300℃~350℃ D.350℃~2050℃
(4)关于钠硫电池,下列说法正确的是______(填字母序号)。
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为![]() 2e
2e![]() xS
xS
(5)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的c(OH-)=0.1mol/L时,电路中通过的电子的物质的量为_________mol,两极的反应物的质量差为_________g。(假设电解前两极的反应物的质量相等)
III.(6)在标准状态即压力为100kPa,一定温度下,由元素最稳定的单质生成生成 1mol 纯化合物时的反应热称为该化合物的标准摩尔生成焓(ΔfHΘm)。已知 100kPa,一定温度下:
Fe2 O 3(s+3C(石墨)=2Fe(s)+3CO(g) △H=+490.0 kJ/mol
CO(g)+1/2O2(g)=CO2 (g) △H=-280.0kJ/mol
C(石墨)+O2 ( g)=CO2 (g) △H=-390.5kJ/mol
则 Fe2O3 的标准摩尔生成焓ΔfHΘm=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1 NaOH溶液以备使用。
Ⅰ.该同学应称取NaOH固体________g。容量瓶的使用之前需要_____。溶液的配置过程操作步骤如图2所示,则图1操作应在图2中的___(填选项字母)之间。操作②中液体转移到容量瓶要注意__________。图⑤操作的名称是________,进行该操作时要注意_________________。
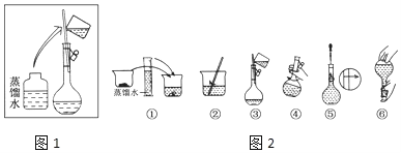
A.②与③ B.①与② C.④与⑤ D.⑤与⑥
Ⅱ.实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶
F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假定把![]() C的相对原子质量改为24,那么下列叙述错误的是
C的相对原子质量改为24,那么下列叙述错误的是
A. 此时16O的相对原子质量为32
B. NA个O2与NA个H2的质量比为16:1
C. N2的摩尔质量为56g/mol
D. 标准状况下,16g O2的体积约为5.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL 0.1mol/L的盐酸中逐滴加入0.2mol/L的氨水,溶液的pH与所加氨水的体积关系如图所示,下列说法正确的是

A. a、b、c三点比较,水的电离程度a点最大
B. 在c点:c(NH4+)+c(NH3·H2O)= 0.2mol/L
C. 在a点:c(OH-)<c(H+)<c(NH4+)<c(NH3·H2O)<c(Cl-)
D. 在b点,盐酸与氨水恰好完全中和, c(NH4+)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,a、b、c、d、e、f 均为惰性电极,电解质溶液均足量。接通电源后,d 极附近显红色。下外说法正确的是

A. 电源B 端是正极
B. f 极附近红褐色变深,说明氢氧化铁胶粒带正电
C. 欲用丁装置给铜镀银,N 应为Ag,电解质溶液为AgNO3溶液
D. a、c电极均有单质生成它们的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4的反应使之转化为CO 和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知该转化反应为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH,则加快该反应的化学反应速率,应采用的有效措施有___________________________(填写两种)。
2CO(g)+2H2(g) ΔH,则加快该反应的化学反应速率,应采用的有效措施有___________________________(填写两种)。
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH,测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g) ΔH,测得CH4的平衡转化率与温度、压强的关系如下图所示。

①由图可知,该反应的ΔH_____0 (填写“大于”或者“小于”),P1、P2、P3、P4由大到小的顺序为_________________________。
②工业生产时一般会选用P4和1250℃进行合成,请解释其原因______________________________。
③在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为_________________mol·L-1·min-1。
④该温度下,反应的平衡常数K的数学表达式为K=_______,经计算K的数值为K=_____________(保留3位有效数字),若要使K减小可采取的措施是_________________。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) ![]() CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。
① 在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是_______________
A. H2、CO和H2O的物质的量之比为1:1:1 B.体系压强不再变化
C. 气体平均相对分子质量不变 D.混合气体的密度保持不变
② 在某密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和一定量的C(s),如果此时对体系加压,平衡向_______(填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实
A. 苯不能使溴水褪色 B. 能与H2发生加成反应
C. 溴苯没有同分异构体 D. 邻二溴苯只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础
如图为实验装置

(1)写出下列仪器的名称:a.___________________ b. __________________________.
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器是____________________________将仪器补充完整后进行实验,温度计水银球的位置在________________________ 处。冷凝水由_____(填 f 或 g)口通入 ________(填 f 或 g)流出。
(3)实验时 A 中除加入少量自来水外,还需加入少量_________,其作用是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com