
| 温度/℃ | n(活性炭)/mol | n(CO2)/mol |
| T1 | 0.70 | |
| T2 | 0.25 |
| A. | 上述信息可推知:T1<T2 | |
| B. | T1℃时,该反应的平衡常数K=$\frac{9}{16}$ | |
| C. | T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小 | |
| D. | T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变 |
分析 A.温度T1时,消平衡时耗的n(活性炭)=1mol-0.7mol=0.3mol,则平衡时生成的n(CO2)=0.3mol,温度T2时,生成的n(CO2)=0.25mol<0.3mol,正反应为放热反应,升温平衡逆向移动;
B.温度T1,平衡时n(NO)=0.4mol,(N2)=0.3mol,n(CO2)=0.3mol,反应气体气体体积不变,用物质的量代替浓度代入平衡常数K=$\frac{c({N}_{2})×c(C{O}_{2})}{{c}^{2}(NO))}$计算;
C.T1℃时,若开始时反应物的用量均减小一半,等效为降低压强,反应前后气体体积不变,平衡不移动;
D.平衡后再缩小容器的体积,压强增大,反应前后气体体积不变,平衡不移动.
解答 解:A.温度T1时,消平衡时耗的n(活性炭)=1mol-0.7mol=0.3mol,则平衡时生成的n(CO2)=0.3mol,温度T2时,生成的n(CO2)=0.25mol<0.3mol,平衡逆向移动,正反应为放热反应,升温平衡逆向移动,故温度T1<T2,故A正确;
B.温度T1时,活性炭的平衡物质的量为0.70mol,则消耗的n(活性炭)=1mol-0.7mol=0.3mol,故消耗的n(NO)=0.6mol,平衡时n(NO)=1mol-0.6mol=0.4mol,生成的n(N2)=0.3mol,生成的n(CO2)=0.3mol,反应气体气体体积不变,用物质的量代替浓度计算平衡常数,故K=$\frac{c({N}_{2})×c(C{O}_{2})}{{c}^{2}(NO))}$=$\frac{0.3×0.3}{0.{4}^{2}}$=$\frac{9}{16}$,故B正确;
C.T1℃时,若开始时反应物的用量均减小一半,等效为降低压强,反应前后气体体积不变,平衡不移动,NO的转化率不变,故C错误;
D.平衡后再缩小容器的体积,压强增大,反应前后气体体积不变,平衡不移动,故c (N2):c (NO)不变,故D正确;
故选:C.
点评 本题考查化学平衡计算与影响因素、化学平衡常数,难度中等,注意反应前后气体体积不变,压强不影响平衡移动.


科目:高中化学 来源: 题型:选择题
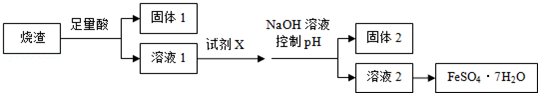
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
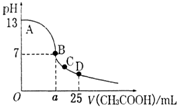 室温下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,pH 与滴加 CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )
室温下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,pH 与滴加 CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )| A. | 全部正确 | B. | ①② | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com