
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.5℃ | |
分析 (1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;
(2)金属导热快,热量损失多;
(3)先判断温度差的有效性,然后求出温度差平均值,再根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;中和热测定实验成败的关键是保温工作;
(4)根据中和热的概念分析;弱电解质电离吸热.
解答 解:(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,所以还缺少温度计;
故答案为:温度计;
(2)不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝搅拌棒是热的良导体,热量损失大;
故答案为:不能;
(3)2次温度差分别为:3.3℃,3.5℃,2组数据都有效,温度差平均值=3.4℃,50mL0.55mol•L-1NaOH和50mL.0.5mol•L-1HCl质量和为m=100mL×1g/mL=100g,c=4.18J/(g•℃),△T=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.4℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为$\frac{1.4212kJ×1mol}{0.025mol}$=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;分多次把NaOH溶液倒人盛有HCl小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小;
故答案为:-56.8kJ/mol;分多次把NaOH溶液倒人盛有HCl小烧杯中;
(4)在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热,若用KOH代替NaOH,测定结果无影响,醋酸为弱酸,电离过程为吸热过程,所以用醋酸代替HCl做实验,反应放出的热量小于56.8kJ,测定结果偏小;
故答案为:无;偏小.
点评 本题考查中和热的测定,题目难度中等,注意理解中和热的概念、把握中和热测定的原理和方法,注意测定反应热的误差.


科目:高中化学 来源: 题型:选择题
| A. | H+、NH4+、CO32- | B. | Fe3+、Cl-、NO3- | C. | Na+、OH-、HCO3- | D. | Al3+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气、石油、煤、油脂都属于化石燃料 | |
| B. | 蔗糖及其水解产物均可发生银镜反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体 | |
| D. | 油脂在碱性条件下的水解反应又称为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
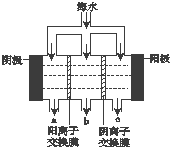 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Na2S4O6、H2O、Na2S2O3、Au2O、NaOH | |
| B. | Na2S2O3、NaOH、Na2S4O6、Au2O、H2O | |
| C. | Na2S2O3、H2O、Na2S4O6、Au2O、NaOH | |
| D. | 当1 mol Au2O3完全反应时,转移电子8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com