
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 第2周期 | | | | ⑥ | | ⑦ | | |
| 第3周期 | ① | ③ | ⑤ | | ⑧ | | ⑨ | ⑩ |
| 第4周期 | ② | ④ | | | | | | |
 ;
;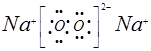
 ①是Na,⑦是O,两元素形成四核化合物的电子式是
①是Na,⑦是O,两元素形成四核化合物的电子式是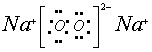
 Na2O2与CO2反应的化学方程式为2Na2O2 + 2CO2 = 2Na2CO3 +O2
Na2O2与CO2反应的化学方程式为2Na2O2 + 2CO2 = 2Na2CO3 +O2

科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1s22s22p3 | B.1s22s22p5 |
| C.1s22s22p63s23p4 | D.1s22s22p2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铍的原子半径大于硼的原子半径 | B.铍原子的最外层电子数是8 |
| C.氢氧化铍的碱性比氢氧化钙的强 | D.单质铍跟冷水反应产生氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
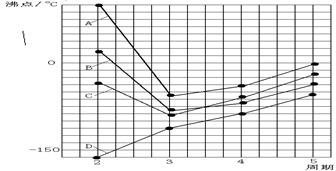
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.砷在通常状况下为固体 |
| B.砷的最高正化合价为+5 |
| C.砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)强 |
| D.砷化氢(AsH3)不如氨气(NH3)稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
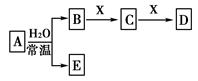
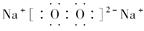
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com