
| A. | 先加入足量的高锰酸钾溶液,然后再加溴水 | |
| B. | 加入浓硫酸和浓硝酸后再加热 | |
| C. | 先加入足量的溴水,然后再加入高锰酸钾酸性溶液 | |
| D. | 点燃这种液体,然后再观察火焰的明亮程度 |
分析 己烯和甲苯都能与酸性高锰酸钾反应,不能用高锰酸钾鉴别,但己烯可与溴水发生加成反应,而甲苯与溴水不反应,可发生萃取,溶液分层,以此解答该题.
解答 解:A.先加足量的酸性高锰酸钾溶液,二者均能是高锰酸钾褪色,不能鉴别己烯中是否混有少量甲苯,故A错误;
B.操作太麻烦,加热、控温、搅拌、回流等等,且还耗时长,甲苯是少量,不一定能观察到黄色,则不能鉴别己烯中是否混有少量甲苯,故B错误;
C.先加足量溴水,己烯与溴水发生加成反应,排除双键的影响,然后再加入酸性高锰酸钾溶液,褪色可说明己烯中混有少量甲苯,故C正确;
D.二者均含有C、H元素,不能利用燃烧来鉴别己烯中是否混有少量甲苯,故D错误.
故选C.
点评 本题考查有机物的鉴别,明确常见有机物的性质是解答本题的关键,注意烯烃与甲苯的性质来分析解答,选项B为解答的难点,题目难度中等.


科目:高中化学 来源: 题型:解答题
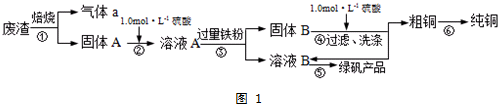
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.90 | 20.02 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
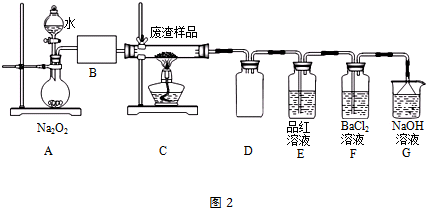
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
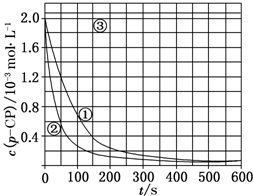 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | |||
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ①③④⑤ | C. | ①④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;B与溴水反应生成的物质名称为1,2-二溴乙烷;
;B与溴水反应生成的物质名称为1,2-二溴乙烷;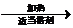
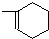 .
.| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ OH- SO42- HCO3- | B. | OH- NH4+ SO42- Ba2+ | ||
| C. | Fe2+ H+ SO42- NO3- | D. | H+ K+ Cl- HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com