
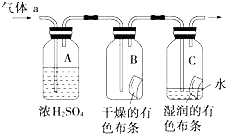
 甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:
甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:分析 (1)浓硫酸具有吸水性,常用作干燥剂,在实验中吸收气体中的水的作用;
(2)干燥氯气不具有漂白性,次氯酸具有漂白性;
(3)实验室用氢氧化钠溶液吸收多余的Cl2,生成氯化钠和次氯酸钠,所以离子反应为Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气在碱性条件下自身发生氧化还原反应,可与石灰乳反应生成氯化钙和次氯酸钙,置露在空气的漂白粉与二氧化碳、水的反应生成具有漂白作用的次氯酸.
解答 解:(1)制得的氯气中含有水蒸气,需要用浓硫酸干燥,所以浓硫酸的作用是除去氯气中的水蒸气,干燥氯气;
故答案为:除去氯气中的水蒸气,干燥氯气;
(2)干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O?HCl+HClO,次氯酸具有漂白性,
故答案为:装置B中的有色布条不褪色,装置C中的有色布条褪色;Cl2+H2O=HCl+HClO;
(3)实验室用氢氧化钠溶液吸收多余的Cl2,生成氯化钠和次氯酸钠,所以离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气与石灰乳反应生成氯化钙和次氯酸钙,反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,同时生成碳酸钙沉淀,反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:2Cl2+2 Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;Ca(ClO)2+CO2+H2O═CaCO3↓+2 HClO.
点评 本题考查氯气的性质实验,为高频考点,侧重分析能力及实验能力及所学知识分析问题、解决问题的能力的综合考查,注意氯气的漂白性的探究实验原理,题目难度中等.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1 molCO、2 mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 衡 时 数据 | CH3OH的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | a1 | a2 | a3 | |
| A. | 2 c1>c3 | B. | |a|+|b|=90.8 | C. | 2 p2<p3 | D. | a1+a3<1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用作净水剂:Fe3++H2O?Fe(OH)3+3H+ | |
| B. | 用于制印刷电路的腐蚀液:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 与小苏打溶液反应:Fe3++3HCO3-═Fe(OH)3↓+3CO2↑ | |
| D. | 遇KSCN 溶液变红色:Fe3++3SCN-═Fe(SCN)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学性质 | 实际应用 | |
| A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
| B | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
| C | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
| D | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
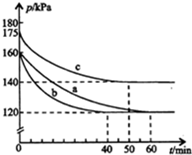 在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )
在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )| A. | Q<0 | |
| B. | 与实验a相比,实验b加入了催化剂 | |
| C. | 实验b条件下,该反应的平衡常数K=2 | |
| D. | 实验c从反应开始至达到平衡时的平均反应速率为v(AX5)=4.0×10-3mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
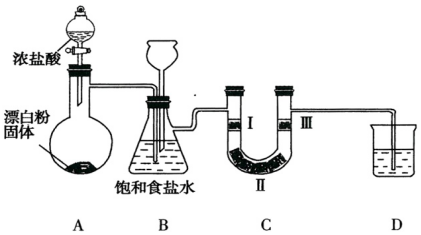
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com