
| A、pH=12的溶液中:K+,Na+,AlO2-,S2-,SO32- |
| B、无色溶液中:K+,Cl-,MnO4-,PO43-,SO42- |
| C、水电离的H+浓度C(H+)=10-12mol?L-1的溶液中:ClO-,SO42-,NO3-,NH4+,Na+ |
| D、某强酸性溶液中:Fe2+,Al3+,NO3-,I-,Cl- |


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
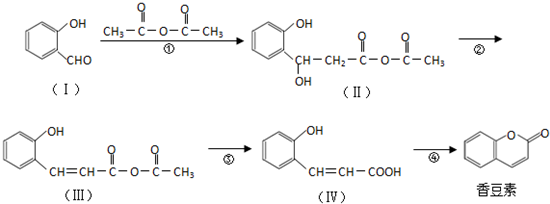
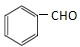 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
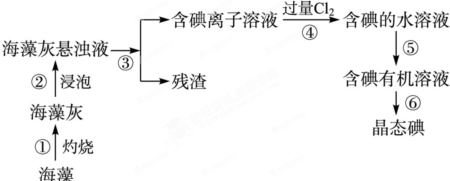
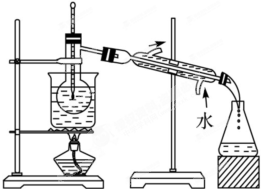
查看答案和解析>>
科目:高中化学 来源: 题型:
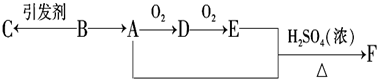
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=12的1.0L NaClO溶液中水电离出的OH-的数目为0.01NA |
| B、等物质的量的N2和C0所含电子数均为NA |
| C、Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| D、在c(H+)水?c(OH-)水=10-26的溶液中能大量共存:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H++OH-═H2O |
| B、CO32-+2H+═H2O+CO2↑ |
| C、Zn(OH)2+2H+═Zn2++2H2O |
| D、Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
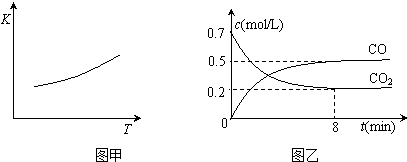
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Na2O和Na2O2的混合物中所含阴离子数为NA |
| B、1.7g H2O2中含有的电子数为0.9 NA |
| C、1 mol Na2O2与足量的CO2反应,电子转移数为2NA |
| D、标准状况下,2.24LCO2和CO中所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=c(HS-)+c(S2-)+(H2S) |
| B、c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| C、c(Na+)>c(S2-)>c(OH-)>c(HS-) |
| D、c(OH-)=c(HS-)+c(H+)+c(H2S) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com