

分析 (1)依据配制一定物质的量浓度溶液的一般步骤,选择需要的仪器;
(2)容量瓶不能稀释浓溶液、不能用于溶解固体、储存溶液等;
(3)依据m=CVM计算需要溶质的质量;根据左码右物称量药品时,药品的实际质量=砝码的质量-游码的质量,精确值为0.1g;
(4)根据c=$\frac{1000ρω}{M}$计算出该浓硫酸的物质的量浓度,再根据配制过程中溶质硫酸的物质的量不变计算出需要浓硫酸的体积;
硫酸与水的密度不同,水分子与硫酸分子间有间隙,等体积混合,混合所得溶液的总体积小于硫酸体积的二倍;
硫酸的浓度越大密度越大,该硫酸与等质量的水混合,质量变为2倍,密度降低,体积比原浓硫酸的2倍大,结合稀释定律判断.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量(量取)、溶解(稀释)、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少的仪器:500mL容量瓶、胶头滴管;
故答案为:500mL容量瓶、胶头滴管;
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,
故选BCD;
(3)需要0.1mol•L-1 NaOH溶液450mL,应选择500mL容量瓶,需要溶质的质量m=0.1mol/L×40g/mol×
0.5L=2.0g;
图中物质和砝码的位置放反了,质量关系应为:砝码的质量=烧杯的质量+游码显示的质量.即30 g=烧杯的质量+2.6 g,得烧杯的质量为:30g-2.6g=27.4g.
故答案为:2.0;27.4;
(4)分数为98%、密度为1.84g•cm-3的浓硫酸的浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
设需要浓硫酸体积为V,则V×18.4mol/L=0.5mol/L×500mL,解得V=13.6mL;
硫酸与等体积水混合后,所得溶液中硫酸的物质的量不变,则稀释前后,硫酸的物质的量不变,C1V1=C2V2,所以C2=$\frac{{C}_{1}{V}_{1}}{{V}_{2}}$=$\frac{18.4{V}_{1}}{{V}_{2}}$,但是V2<2V1,所以所得溶液的物质的量浓度大于9.2mol/L;
硫酸的浓度越大密度越大,该硫酸与等质量的水混合,质量变为2倍,密度降低,体积比原浓硫酸的2倍大,根据稀释定律,稀释前后溶质硫酸的物质的量不变,所以浓度小于原浓硫酸的$\frac{1}{2}$,混合所得溶液的物质的量浓度小于9.2 mol/L;
故答案为:13.6;>;<;
点评 本题考查了一定物质的量浓度溶液的配制及有关物质的量计算,明确配制原理及硫酸溶液的密度与浓度的关系是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| B. | 用澄清石灰水鉴别Na2CO3、NaHCO3两种溶液 | |
| C. | 用萃取分液的方法除去酒精中的水 | |
| D. | 用可见光束照射以区别溶液和胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| 4.0 | 500 | 烧杯、量筒、玻璃棒、药匙、托盘天平、胶头滴管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步 骤 | 现 象 |
| Ⅰ.将NaCl溶液与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.将Ⅱ中经过滤洗得到的黑色沉淀分成两份,在一份沉淀中加蒸馏水,另一份沉淀中加入NaCl溶液,同时浸泡较长时间. | 加蒸馏水的沉淀仍为黑色,加入NaCl溶液的沉淀变为乳白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
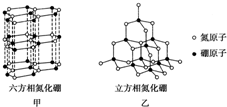 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com