
分析 (1)NaHCO3为强碱弱酸盐,水解呈碱性;
(2)Na2S以第一步水解为主;
(3)NaHCO3溶液跟Al2(SO4)3溶液发生互促水解反应生成氢氧化铝沉淀和二氧化碳气体;
(4)硫酸亚铁溶液中,亚铁离子在溶液中发生水解生成氢氧化亚铁和氢离子,为了抑制亚铁离子水解,通常加入少量的稀硫酸;亚铁离子容易被 氧化成铁离子,为了防止亚铁离子被氧化,配制完毕后需要加入少量铁屑;AlCl3为强酸弱碱盐,加热促进水解生成氢氧化铝和盐酸,盐酸易挥发,氢氧化铝可分解.
解答 解:(1)碳酸氢钠溶液中,碳酸氢根离子部分水解:HCO3-+H2O?H2CO3+OH-,则溶液显示碱性,故答案为:>;HCO3-+H2O?H2CO3+OH-;
(2)Na2S以第一步水解,Na2S的水解程度大于NaHS,所以Na2S的PH大于NaHS,溶液中还存在HS-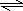 H++S2-,所以两种溶液中微粒种类相同,
H++S2-,所以两种溶液中微粒种类相同,
故答案为:>;=;
(3)硫酸铝和碳酸氢钠水溶液中发生双水解生成氢氧化铝沉淀和二氧化碳,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
故答案为:产生大量的气体和沉淀;Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)实验室配制的FeSO4溶液中,由于亚铁离子部分水解生成氢氧化亚铁,反应的离子方程式为:Fe2++2H2O?Fe(OH)2+2H+,为了制Fe2+的水解,通常加入稀硫酸,使氢离子浓度增大,水解平衡向左移动,即抑制Fe2+水解;
由于Fe2+极易被O2氧化而变为黄色的Fe3+溶液,所以配制完毕后要加入少量铁屑,防止Fe2+被空气中的氧气氧化成Fe3+,
AlCl3为强酸弱碱盐,加热促进水解生成氢氧化铝和盐酸,盐酸易挥发,灼烧氢氧化铝可分解生成Al2O3,
故答案为:防止Fe2+水解;防止Fe2+被空气中的氧气氧化;Al2O3.
点评 该题是基础性试题的考查,试题难易适中,基础性强.该题的关键是明确盐类水解的原理,然后结合提高信息灵活运用即可,有利于培养学生的灵活应变能力,答题时注意离子反应方程式的正确书写.


科目:高中化学 来源: 题型:选择题
| A. | 蛋白质水解的最终产物是多肽 | B. | 淀粉水解的最终产物是葡萄糖 | ||
| C. | 纤维素能水解成葡萄糖 | D. | 油脂水解产物之一是甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加SO2的体积百分比浓度 | |
| B. | 防止矿尘阻塞管道 | |
| C. | 防止催化剂中毒,防止水蒸气跟SO2、SO3结合腐蚀设备 | |
| D. | 炉气中含有的大量N2必须除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解能得到乙烯,乙烯是生产聚乙烯的原料 | |
| B. | 丙烷、丙烯都属于烃,都有同分异构体 | |
| C. | 葡萄糖可转化为乙醇,乙醇氧化可得到乙醛 | |
| D. | 煤干馏为化学变化,石油分馏是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是锌,B是铜,C为稀H2SO4 | B. | A是铜,B是锌,C为稀H2SO4 | ||
| C. | A是铁,B是银,C为AgNO3溶液 | D. | A是Ag,B是铁,C为AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表是某超市出售的加碘食盐的有关说明:
下表是某超市出售的加碘食盐的有关说明:| 配 料 表 | 精制盐、碘酸钾 |
| 含 碘 量 | 45±5mg/kg |
| 储 藏 方 法 | 通风、防潮 |
| 食 用 方 法 | 根据烹调所需适量加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇中含有的氧原子数为NA | |
| B. | 标准状况下,22.4L37Cl2中所含中子数为40NA | |
| C. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有SO42- | B. | 含有SO42- 或Ag+ | ||
| C. | 含有SO42- 或Ag+ 或SO32- | D. | 可能含有SO32- 或CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com