
| A. | 硫酸溶液与氢氧化钡溶液:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| B. | 硫酸与氢氧化镁溶液:H++OH-═H2O | |
| C. | 碳酸钙与稀硝酸:CO32-+2H+═CO2↑+H2O | |
| D. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ |
分析 A.氢离子、氢氧根离子的系数错误,不满足硫酸、氢氧化钡的化学式组成;
B.氢氧化镁是难溶物质,要写成化学式;
C.碳酸钙是难溶物质,要写成化学式;
D.铁与稀硫酸反应生成亚铁离子和氢气.
解答 解:A.氢氧化钡溶液与稀硫酸反应生成硫酸钡沉淀和水,正确的离子方程式为:Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O,故A错误;
B.氢氧化镁是难溶物质,要写成化学式,硫酸与氢氧化镁反应的离子方程式为:2H++Mg(OH)2═Mg2++2H2O,故B错误;
C.碳酸钙是难溶物质,要写成化学式,则碳酸钙与稀硝酸的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O,故C错误;
D.铁与稀硫酸反应生成亚铁离子和氢气,则铁与稀硫酸反应:Fe+2H+═Fe2++H2↑,故D正确.
故选D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意化学式拆分、注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.


 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
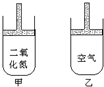 常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:
常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:| A. | ①甲>乙②甲>乙 | B. | ①甲>乙②甲<乙 | C. | ①甲<乙②甲>乙 | D. | ①甲>乙②甲=乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
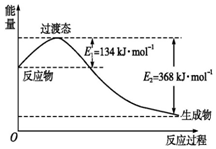 写出下列反应的热化学方程式
写出下列反应的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液 | B. | 悬浊液 | C. | 乳浊液 | D. | 胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应条件是加热的反应都是吸热反应 | |
| B. | 化学反应除了生成新的物质外,通常放出大量热 | |
| C. | 物质燃烧一定是放热反应 | |
| D. | 放热的化学反应不需要加热就能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:1 | B. | 10:1 | C. | 1:10 | D. | 9:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 可逆反应达到化学平衡时,正、逆反应速率都为0 | |
| D. | 反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | VA=0.15 mol•L-1•min-1 | B. | VC=0.6 mol•L-1•min-1 | ||
| C. | VB=0.6 mol•L-1•min-1 | D. | VD=0.1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
| A. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,滴加氢氧化钠溶液时Fe2+先产生沉淀 | |
| B. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,若除去混合溶液中的Fe2+、Fe3+,可先加入稀硝酸,再加入氧化铜调节溶液的pH的范围为3.2-4.7 | |
| C. | 相同温度下,Ksp[(Cu(OH)2)>Ksp[(Fe(OH)2) | |
| D. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,除去混合溶液中的Fe2+、Fe3+,可加入足量的铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com