
| A. | 用氯气和氢氧化钠溶液制消毒水 | B. | 用铝热法冶炼金属钒 | ||
| C. | 用油脂制肥皂 | D. | 海水提溴 |
科目:高中化学 来源: 题型:选择题
| A. | 11.2L | B. | 5.6L | C. | 4.48L | D. | 2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
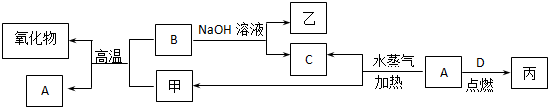
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 12.5% | C. | 17.5% | D. | 25% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2分子比H原子更稳定 | |
| B. | 可求出Cl-Cl 的键能为428 kJ/mol | |
| C. | 1mol氢气与1mol氯气所含的总能量比2mol HCl所含的总能量高 | |
| D. | 理论上利用此反应制取盐酸的同时,可依据原电池原理获取电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
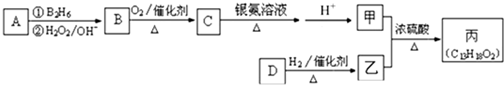
 -CH=CHCHO
-CH=CHCHO -CH2CH2CH2OH
-CH2CH2CH2OH (CH3)2CHCOOCH2CH2CH2-
(CH3)2CHCOOCH2CH2CH2- +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)═c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
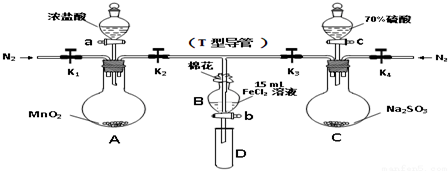
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com