


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
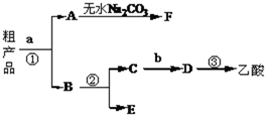 实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:
实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a的取值范围为0.9g<a<1.2g |
| B、镁铝合金与盐酸反应时转移电子的数目为0.1NA |
| C、镁铝合金与盐酸反应产生H2的体积在常温常压下大于1.12L |
| D、x=2y |
查看答案和解析>>
科目:高中化学 来源: 题型:
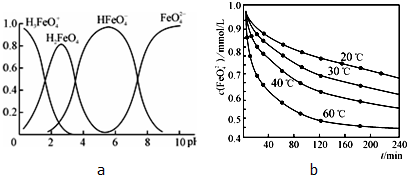
 绿矾是一种重要的化工原料.
绿矾是一种重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、46 | B、23 |
| C、11.5 | D、5.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液和AlCl3溶液 |
| B、FeBr2溶液和氯水 |
| C、NaHCO3溶液和澄清石灰水 |
| D、Ca(HCO3)2溶液和澄清石灰水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com