
铁及其化合物在生产和生活中有着广泛的应用。某实验小组设计了如下实验探究
某些含铁化合物的制备、组成、性质等。请按要求回答下列问题:
(1)铁的氯化物的制备与组成:在实验室中,FeCl2可用________和盐酸反应制备,FeCl3可用铁粉和
________反应制备。现有一含有FeCl2和FeCl3的混合物样品,测得n(Fe)∶n(Cl)=1∶2.2,则该样
品中FeCl2和FeC13物质的量之比为__________。
(2)水处理剂和高容量电池材料――高铁酸钾(K2FeO4)的制备与应用:
FeC13与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
________________________________________________________________________;
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,其正极电极反应式为
________________________________________________________________________。
(3)光敏材料三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)中铁元素含量的测定:
步骤一:称量10.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00
mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳。同时MnO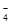 被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0200
mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO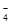 还原成Mn2+。
还原成Mn2+。
重复步骤二、三操作,步骤三消耗0.0200 mol/L KMnO4溶液19.98 mL。
①步骤一中除量筒、玻璃棒、烧杯外,还需要的玻璃仪器有____________________;步骤三滴定过程中盛装KMn4溶液的仪器名称为___________;滴入最后一滴溶液时,锥形瓶中溶液变为_________色,静置半分钟溶液颜色不再变化,确认为滴定终点。
②步骤二加入锌粉的目的是_______________________________;
写出锌参与反应的离子方程式:____________________________________________。
③实验测得该晶体中铁元素的质量分数为____________。在步骤二中,若加入的KMnO4溶液的量不足,则测得的铁元素含量____________。(填“偏低”“偏高”或“无影响”)
(18分)(1)铁粉 氯气 (2分);4∶1(2分)
(2)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O(2分)
FeO42-+3e-+4H2O=Fe(OH)3↓+5OH-(2分)
(3)①250ml容量瓶和胶头滴管(2分);酸式滴定管 红(2分)
②将Fe3+还原成Fe2+(1分);Zn+2Fe3+=Zn2++2Fe2+(2分) ③11.2%(2分) 偏高(1分)
【解析】
试题分析:(1)铁是变价金属,与强氧化剂反应生成+3价铁,与弱氧化剂反应生成+2价铁,所以在实验室中,FeCl2可用铁和盐酸反应制备,FeCl3可用铁粉和氯气反应制备。设样品中FeCl2和FeC13物质的量分别是x 和y,则根据混合物n(Fe)∶n(Cl)=1∶2.2可知,(x+y):(2x+3y)=1∶2.2,解得x∶y=4∶1。
(2)FeC13与KClO在强碱性条件下反应可制取K2FeO4,在反应中氯元素的化合价从+1价降低到—1价,得到2个电子。铁元素的化合价从+3价升高到+6价,失去3个电子,即还原剂与氧化剂的物质的量之比是2:3,因此该反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;原电池种正极得到电子,所以在K2FeO4-Zn碱性电池中,锌是负极,K2FeO4是正极,所以正极电极反应式为FeO42-+3e-+4H2O=Fe(OH)3↓+5OH-。
(3)①配制一定物质的量浓度溶液时,除量筒、玻璃棒、烧杯外,还需要的玻璃仪器有250ml容量瓶和定容的胶头滴管。由于高锰酸钾溶液极易强氧化性,且显酸性,所以步骤三滴定过程中盛装KMn4溶液的仪器名称为酸式滴定管;酸性高锰酸钾溶液显红色,所以滴入最后一滴溶液时,锥形瓶中溶液变为红色,静置半分钟溶液颜色不再变化,确认为滴定终点。
②由于酸性高锰酸钾溶液也能把亚铁离子氧化生成铁离子,所以加入锌粉的作用是将Fe3+还原成Fe2+,反应的离子方程式为Zn+2Fe3+=Zn2++2Fe2+。
③两次实验中消耗0.0200
mol/L KMnO4溶液的平均值=(20.02 mL+ 19.98 mL)÷2=20.00ml,所以消耗高锰酸钾的物质的量是0.0200L×0.0200 mol/L=0.0004mol。根据电子得失守恒可知,溶液中亚铁离子的物质的量=0.0004mol×5=0.0020mol,所以该晶体中铁元素的质量分数为 ×100%=11.2%。在步骤二中,若加入的KMnO4溶液的量不足,则可能导致草酸根剩余,从而导致第三步中消耗高锰酸钾溶液的体积增加,从而导致铁元素的含量偏高。
×100%=11.2%。在步骤二中,若加入的KMnO4溶液的量不足,则可能导致草酸根剩余,从而导致第三步中消耗高锰酸钾溶液的体积增加,从而导致铁元素的含量偏高。
考点:考查铁及其化合物的性质;氧化还原反应方程式的配平;电极反应式的书写以及氧化还原滴定法的有关判断和计算等


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
 镁、铝、铁及其化合物在生产和生活中有广泛的应用.
镁、铝、铁及其化合物在生产和生活中有广泛的应用.| 实验序号 | I | II | III |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
| 0.12 |
| 28.12 |
| 0.12 |
| 28.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省黄山市毕业班第一次质量检测化学试卷(解析版) 题型:实验题
铁及其化合物在生产和生活中有着广泛的应用。
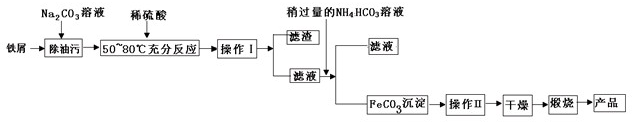
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:回答下列问题:

①操作Ⅰ、Ⅱ的名称分别是____、____。
②写出在空气中煅烧FeCO3的化学方程式 ;
③煅烧如果不充分,产品中将有Fe2+ 存在,试设计实验检验产品中有无Fe2+ 。
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。称取2.850g绿矾(FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;量取25.00mL待测溶液于锥形瓶中;用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式
②计算上述样品中FeSO4·7H2O的质量分数为 [已知M(FeSO4·7H2O)=278g/mol]
③滴定达到终点时锥形瓶中溶液颜色变化为
④下列操作会导致样品中FeSO4·7H2O的质量分数的测定结果偏高的有_____________。
a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c. 滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市奉贤区高三上学期期末教学质量调研化学试卷(解析版) 题型:计算题
镁、铝、铁及其化合物在生产和生活中有广泛的应用。
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg): n(Al)= 。
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
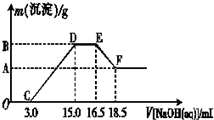
(3)现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是 。

(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为 (最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
加入钢样粉末的质量(g) |
2.812 |
5.624 |
8.436 |
|
生成气体的体积(L)(标准状况) |
1.120 |
2.240 |
2.800 |
则该硫酸溶液的物质的量浓度为 。
③若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为 g (保留3位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com