
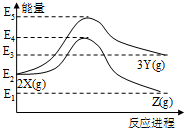
| A. | 由X→Y反应的△H=E5-E2 | |
| B. | 由X→Z反应的△H>0 | |
| C. | 由图可知等物质的量的Y的能量一定比X的能量高 | |
| D. | 升高温度可提高X→Z的反应速率 |
分析 由图象可知2X(g)≒3Y(g)为吸热反应,而2X(g)≒2Z(g)为放热反应,反应热等于反应物的总能量-生成物的总能量,结合温度对反应速率的影响解答该题.
解答 解:A.根据化学反应的实质,由X→Y反应的△H=E3-E2,故A错误;
B.由图象可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即X→Z反应的△H<0,故B错误;
C.由图象可知,2X(g)≒3Y(g)为吸热反应,只能说明3molY的能量一定比2molX的能量高,则不能得出等物质的量的Y的能量一定比X的能量高,故C错误;
D.升高温度,反应速率增大,所以升高温度可提高X→Z的反应速率,故D正确.
故选D.
点评 本题考查了化学反应中能量的变化图,侧重于学生的分析能力的考查,注意把握图象的分析,注意根据反应物的总能量与生成物的总能量进行比较,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
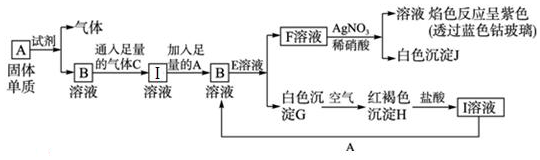
科目:高中化学 来源: 题型:实验题

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| |温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
| 平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物质能来深于植物及其加工产品所贮存的能量,直接燃烧是利用方式之一 | |
| B. | 石油的裂化与裂解都是化学变化,而煤的气化与液化是物理变化 | |
| C. | 用高压氢气、氧气制作燃料电池是氢能源利用的一种重要方式 | |
| D. | 化学反应过程中反应物的总能量小于生成物的总能量,往往伴随热量的吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净物:水银、氢氧化铁固体、冰水混合物 | |
| B. | 碱性氧化物:Na2O、Na2O2、Al2O3 | |
| C. | 盐:纯碱、小苏打、烧碱 | |
| D. | 电解质:CH3COOH、H2O、NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入适量水 | B. | 加入适量NaOH固体 | ||
| C. | 通入适量的O2 | D. | 加入适量的CuSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com