
”¾ĢāÄæ”æ°“ŅŖĒó»Ų“šĻĀĮŠĪŹĢā£ŗ I£®½«µČĪļÖŹµÄĮæµÄA”¢B»ģŗĻ·ÅÓŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢Éś·“Ó¦3A£Øg£©+B£Øg£©xC£Øg£©+2D£Øg£©£®¾5minŗó“ļµ½Ę½ŗā£¬Ę½ŗāŹ±²āµĆDµÄÅضČĪŖ0.5mol/L£¬c£ØA£©£ŗc£ØB£©=3£ŗ5£¬v£ØC£©=0.1mol/£ØLmin£©£®Ōņ£ŗ
£Ø1£©x= £®
£Ø2£©Ē°5minÄŚBµÄ·“Ó¦ĖŁĀŹv£ØB£©= £®
£Ø3£©Ę½ŗāŹ±AµÄ×Ŗ»ÆĀŹĪŖ £®
£Ø4£©II£®Ė®ÕōĘųĶعżÖĖČȵÄĢ¼²ć·¢Éś·“Ó¦£ŗC£Øs£©+H2O£Øg£©CO£Øg£©+H2£Øg£©”÷H£® ŅŃÖŖ£ŗK£Ø300”ę£©£¼K£Ø350”ę£©£¬ŌņøĆ·“Ó¦ŹĒČČ·“Ó¦£®
£Ø5£©ÉĻŹö·“Ó¦ŌŚt0Ź±æĢ“ļµ½Ę½ŗā£¬ŌŚt1Ź±æĢøıäijŅ»Ģõ¼žŗóÕż·“Ó¦ĖŁĀŹ£Ø¦ĶÕż£©Ėꏱ¼äµÄ±ä»ÆČēĻĀĶ¼ĖłŹ¾£¬Ģī³ö¶ŌÓ¦µÄ±ąŗÅ£® 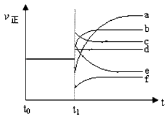
¢ŁĖõŠ”ČŻĘ÷Ģå»ż£» ¢Ś½µµĶĪĀ¶Č
£Ø6£©ŅŃÖŖ·“Ó¦¢ŁCO£Øg£©+CuO£Øg£©CO2£Øg£©+Cu£Øs£©¢ŚH2£Øg£©+CuO£Øg£©Cu£Øs£©+H2O£Øg£© ŌŚĻąĶ¬µÄijĪĀ¶ČĻĀµÄĘ½ŗā³£Źż·Ö±šĪŖK1ŗĶK2 £¬ øĆĪĀ¶ČĻĀ·“Ó¦CO£Øg£©+H2O£Øg£©CO2£Øg£©+H2£Øg£©µÄĘ½ŗā³£ŹżK=£ØÓĆK1ŗĶK2±ķŹ¾£©£®
”¾“š°ø”æ
£Ø1£©2
£Ø2£©0.05mol/£ØL?min£©
£Ø3£©50%
£Ø4£©Īü
£Ø5£©b£» f
£Ø6£©![]()
”¾½āĪö”æ½ā£ŗI£®DµÄÅضČĪŖ0.5mol/L£¬ĖłŅŌDµÄĪļÖŹµÄĮæĪŖ1mol£®CĪļÖŹµÄĮæ=0.1mol/£ØLmin£©”Į2L”Į5min=1mol£¬
ÉčA”¢BµÄĪļÖŹµÄĮæĪŖnmol£¬
3A£Øg£©+ | B£Øg£©= | xC£Øg£©+ | 2D£Øg£© | |
ĘšŹ¼(mol) | n | n | 0 | 0 |
×Ŗ»Æ(mol) | 1.5 | 0.5 | 1 | 1 |
5min(mol) | n-1.5 | n-0.5 | 1 | 1 |
Ķ¬Ņ»ČŻĘ÷ÖŠ£¬c£ØA£©£ŗc£ØB£©=n£ØA£©£ŗn£ØB£©= ![]() =
= ![]() £»n=3mol£¬£Ø1£©CµÄ·“Ó¦ĖŁĀŹŹĒ0.1mol/£ØLmin£©£¬CĪļÖŹµÄĮæ=0.1mol/£ØLmin£©”Į2L”Į5min=1mol£¬
£»n=3mol£¬£Ø1£©CµÄ·“Ó¦ĖŁĀŹŹĒ0.1mol/£ØLmin£©£¬CĪļÖŹµÄĮæ=0.1mol/£ØLmin£©”Į2L”Į5min=1mol£¬ ![]() =1£¬ĖłŅŌx=2£¬
=1£¬ĖłŅŌx=2£¬
ĖłŅŌ“š°øŹĒ£ŗ2£»£Ø2£©CµÄ·“Ó¦ĖŁĀŹŹĒ0.1mol/£ØLmin£©£¬øł¾ŻĶ¬Ņ»·“Ó¦ÖŠ£¬ø÷ĪļÖŹµÄ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚ¼ĘĮæŹżÖ®±Č£¬ĖłŅŌBµÄ·“Ó¦ĖŁĀŹŹĒ ![]() ”Į0.1mol/£ØLmin£©=0.05mol/£ØLmin£©£¬
”Į0.1mol/£ØLmin£©=0.05mol/£ØLmin£©£¬
ĖłŅŌ“š°øŹĒ£ŗ0.05mol/£ØLmin£©£»£Ø3£©AµÄ×Ŗ»ÆĀŹĪŖ£ŗ ![]() ”Į100%=50%£¬ĖłŅŌ“š°øŹĒ£ŗ50%£»
”Į100%=50%£¬ĖłŅŌ“š°øŹĒ£ŗ50%£»
¢ņ£®£Ø4£©ŅŃÖŖ£ŗK£Ø300”ę£©£¼K£Ø350”ę£©£¬ĖęĪĀ¶ČÉżøßĘ½ŗā³£ŹżŌö“ó£¬ĖµĆ÷Ę½ŗāÕżĻņ½ųŠŠ£¬Õż·“Ó¦ĪŖĪüČČ·“Ó¦£¬ĖłŅŌ“š°øŹĒ£ŗĪü£» £Ø5£©¢ŁĖõŠ”ČŻĘ÷Ģå»ż£¬Ń¹ĒæŌö“ó£¬Ė²¼äÕżÄę·“Ó¦ĖŁĀŹ¶¼Ōö“ó£¬Ę½¾łĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬Äę·“Ó¦ĖŁĀŹŌö“óøü¶ą£¬ĖęŗóÕż·“Ó¦ĖŁĀŹŌö“󵽊ĀĘ½ŗā£¬¹ŹĒśĻßb·ūŗĻ£¬
ĖłŅŌ“š°øŹĒ£ŗb£»
¢Ś½µµĶĪĀ¶Č£¬Ė²¼äÕżÄę·“Ó¦ĖŁĀŹ¶¼¼õŠ”£¬Ę½¾łĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬Õż·“Ó¦ĖŁĀŹ¼õŠ”øü¶ą£¬ĖęŗóÕż·“Ó¦ĖŁĀŹŌö“󵽊ĀĘ½ŗā£¬µ½“ļŠĀĘ½ŗāŹ±µÄĖŁĀŹŠ”ÓŚŌĘ½ŗāµÄĖŁĀŹ£¬ĒśĻßf·ūŗĻ£¬ĖłŅŌ“š°øŹĒ£ŗf£»£Ø6£©¢ŁCO£Øg£©+CuO£Øg£©CO2£Øg£©+Cu£Øs£©¢ŚH2£Øg£©+CuO£Øg£©Cu£Øs£©+H2O£Øg£©£¬
·“Ó¦¢ŁµÄĘ½ŗā³£ŹżK1= ![]() £¬·“Ó¦¢ŚµÄĘ½ŗā³£ŹżK2=
£¬·“Ó¦¢ŚµÄĘ½ŗā³£ŹżK2= ![]() £¬·“Ó¦¢Ū£ŗCO£Øg£©+H2O£Øg£©CO2£Øg£©+H2£Øg£©µÄĘ½ŗā³£ŹżĪŖK=
£¬·“Ó¦¢Ū£ŗCO£Øg£©+H2O£Øg£©CO2£Øg£©+H2£Øg£©µÄĘ½ŗā³£ŹżĪŖK= ![]() =
= ![]() £¬
£¬
ĖłŅŌ“š°øŹĒ£ŗ ![]() £®
£®


 ŗčĶ¼Ķ¼Źéŗ®¼Ł×÷Ņµ¼ŁĘŚ×÷Ņµ¼ŖĮÖ“óѧ³ö°ęÉēĻµĮŠ“š°ø
ŗčĶ¼Ķ¼Źéŗ®¼Ł×÷Ņµ¼ŁĘŚ×÷Ņµ¼ŖĮÖ“óѧ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹Ų»Æѧ»ł±¾øÅÄīµÄĖµ·ØÕżČ·µÄŹĒ
A.ŌŚĖ®ČÜŅŗÖŠÄܵēĄė³öH+µÄ»ÆŗĻĪļŹĒĖį
B.ČÜŅŗÓė½ŗĢåµÄ±¾ÖŹĒų±š£ŗ·ÖÉ¢ÖŹæÅĮ£µÄÖ±¾¶“óŠ”
C.“æ¾»ĪļÓė»ģŗĻĪļµÄĒų±š£ŗŹĒ·ń½öŗ¬ÓŠŅ»ÖÖŌŖĖŲ
D.øł¾Ż²»Ķ¬µÄĪļÖŹ·ÖĄą±ź×¼£¬“æ¼īæÉ¹éĄąĪŖ¼ī”¢ÄĘŃĪ”¢Ģ¼ĖįŃĪµČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·“Ó¦ÖŠ·ūŗĻČēĶ¼Ķ¼ĻóµÄŹĒ£Ø””””£© 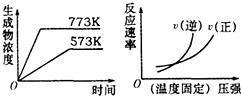
A.N2£Øg£©+3H2£Øg£©2NH3£Øg£©£»”÷H=©Q1kJmol©1 £ØQ1£¾0£©
B.2SO3£Øg£©2SO2£Øg£©+O2£Øg£©£»”÷H=+Q2kJmol©1 £ØQ2£¾0£©
C.4NH3£Øg£©+5O2£Øg£©4NO£Øg£©+6H2O£Øg£©£»”÷H=©Q3kJmol©1£ØQ3£¾0£©
D.H2£Øg£©+CO£Øg£©C£Øs£©+H2O£Øg£©£»”÷H=+Q4kJmol©1©1£ØQ4£¾0£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ”×éĄūÓĆH2C2O4ČÜŅŗŗĶĮņĖįĖį»ÆµÄKMnO4ČÜŅŗ·“Ó¦Ą“Ģ½¾æ”°Ķā½ēĢõ¼ž¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ”±”£ŹµŃ鏱Ķعż²ā¶ØĖįŠŌKMnO4ČÜŅŗĶŹÉ«ĖłŠčŹ±¼äĄ“ÅŠ¶Ļ·“Ó¦µÄæģĀż”£øĆŠ”×éÉč¼ĘĮĖČēĻĀ·½°ø”£ŅŃÖŖ£ŗKMnO4£«H2C2O4£«H2SO4”śK2SO4£«MnSO4£«CO2”ü£«H2O £ØĪ“ÅäĘ½£©”£
0.1mol”¤L£1KMnO4ĖįŠŌČÜŅŗµÄĢå»ż/mL | 0. 6mol”¤L£1 H2C2O4ČÜŅŗµÄĢå»ż/mL | H2OµÄ»ż/mL | ŹµŃéĪĀ¶Č/”ę | ČÜŅŗĶŹÉ«Ź±ĖłŠčŹ±¼ä/min | |
ŹµŃé1 | 10 | V1 | 35 | 25 | |
ŹµŃé2 | 10 | 10 | 30 | 25 | |
ŹµŃé3 | 10 | 10 | V2 | 50 |
(1)±ķÖŠV1=___________mL , V2=___________mL”£
(2)Ģ½¾æĪĀ¶Č¶Ō»Æѧ·“Ó¦ĖŁĀŹÓ°ĻģµÄŹµŃ鱹ŗÅŹĒ________(Ģī±ąŗÅ£¬ĻĀĶ¬)£¬æÉĢ½¾æ·“Ó¦ĪļÅØ¶Č¶Ō»Æѧ·“Ó¦ĖŁĀŹÓ°ĻģµÄŹµŃ鱹ŗÅŹĒ____________”£
(3)ŹµŃé¢Ł²āµĆKMnO4ČÜŅŗµÄĶŹÉ«Ź±¼äĪŖ2 min£¬ŗöĀŌ»ģŗĻĒ°ŗóČÜŅŗĢå»żµÄĪ¢Š”±ä»Æ£¬Õā¶ĪŹ±¼äÄŚĘ½¾ł·“Ó¦ĖŁĀŹv(H2C2O4)£½________________”£
(4)ŅŃÖŖ50 ”ꏱc(MnO![]() )”«·“Ó¦Ź±¼ätµÄ±ä»ÆĒśĻßČēĶ¼”£Čō±£³ÖĘäĖūĢõ¼ž²»±ä£¬ĒėŌŚ×ų±źĶ¼ÖŠ£¬»³ö25 ”ꏱc(MnO
)”«·“Ó¦Ź±¼ätµÄ±ä»ÆĒśĻßČēĶ¼”£Čō±£³ÖĘäĖūĢõ¼ž²»±ä£¬ĒėŌŚ×ų±źĶ¼ÖŠ£¬»³ö25 ”ꏱc(MnO![]() )”«tµÄ±ä»ÆĒśĻߏ¾ŅāĶ¼________”£
)”«tµÄ±ä»ÆĒśĻߏ¾ŅāĶ¼________”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøßĀÆĆŗĘųŹĒĮ¶Ģś³§ÅŷŵÄĪ²Ęų£¬ŗ¬ÓŠH2”¢N2”¢CO”¢CO2¼°O2£¬ĘäÖŠN2Ō¼ĪŖ55%”¢COŌ¼ĪŖ25%”¢CO2Ō¼ĪŖ15%”¢O2Ō¼ĪŖ1.64% (¾łĪŖĢå»ż·ÖŹż)”£Ä³æĘŃŠŠ”×é¶ŌĪ²ĘųµÄÓ¦ÓĆÕ¹æŖŃŠ¾æ£ŗ
I.Ö±½Ó×÷Č¼ĮĻ
¼ŗÖŖ£ŗC(s)+O2(g)=CO2 (g) ”÷H=-393.5kJ/mol
2C(s)+O2(g)=2CO (g) ”÷H=-221kJ/mol
£Ø1£©COČ¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ĪŖ____________________________________________________________________________ ”£
II£®Éś²śŗĻ³É°±µÄŌĮĻ
øßĀÆĆŗĘų¾¹żĻĀĮŠ²½ÖčæÉ×Ŗ»ÆĪŖŗĻ³É°±µÄŌĮĻĘų£ŗ
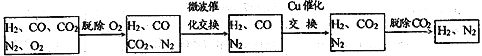
ŌŚĶŃŃõ¹ż³ĢÖŠ½öĪüŹÕĮĖO2£»½»»»¹ż³ĢÖŠ·¢ÉśµÄ·“Ó¦ČēĻĀ£¬ÕāĮ½øö·“Ó¦¾łĪŖĪüČČ·“Ó¦£ŗCO2+CH4![]() CO+H2 CO+H2O
CO+H2 CO+H2O![]() CO2+ H2
CO2+ H2
£Ø2£©ĘųĢåĶعżĪ¢²Ø“߻ƽ»»»ĀÆŠčŅŖ½ĻøßĪĀ¶Č£¬ŹŌøł¾ŻøĆ·“Ó¦ĢŲÕ÷£¬½āŹĶ²ÉÓĆ½ĻøßĪĀ¶ČµÄŌŅņ£ŗ____________________________________________________________________________ ”£
£Ø3£©ĶعżĶ“߻ƽ»»»ĀÆŗó£¬ĖłµĆĘųĢåÖŠV(H2)£ŗV(N2)= ______________”£
III.ŗĻ³É°±ŗóµÄĘųĢåÓ¦ÓĆŃŠ¾æ
£Ø4£©°±ĘųæÉÓĆÓŚÉś²śĻõĖį£¬øĆ¹ż³ĢÖŠ»į²śÉś“óĘųĪŪČ¾ĪļNOx”£ĪŖĮĖŃŠ¾æ¶ŌNOxµÄÖĪĄķ£¬øĆæĘŃŠŠ”×éŌŚŗćĪĀĢõ¼žĻĀ£¬Ļņ2LŗćČŻĆܱÕČŻĘ÷ÖŠ¼ÓČė0.2molNO ŗĶ0.1molCl2£¬·¢ÉśČēĻĀ·“Ó¦£ŗ2NO(g)+Cl2(g)![]() 2ClNO(g) ”÷H<0”£10minŹ±·“Ó¦“ļĘ½ŗā£¬²āµĆ10min ÄŚv (ClNO)=7.5
2ClNO(g) ”÷H<0”£10minŹ±·“Ó¦“ļĘ½ŗā£¬²āµĆ10min ÄŚv (ClNO)=7.5![]() 10-3mol/(L”¤min)£¬ŌņĘ½ŗāŗón(Cl2)=_________mol”£
10-3mol/(L”¤min)£¬ŌņĘ½ŗāŗón(Cl2)=_________mol”£
Éč“ĖŹ±NOµÄ×Ŗ»ÆĀŹĪŖ¦Į1£¬ČōĘäĖüĢõ¼ž²»±ä£¬ÉĻŹö·“Ó¦ŌŚŗćŃ¹Ģõ¼žĻĀ½ųŠŠ£¬Ę½ŗāŹ±NO µÄ×Ŗ»ÆĀŹĪŖ¦Į2£¬Ōņ¦Į1 ____¦Į2 £ØĢī”°£¾”±”¢”°<”±»ņ”°=”±£©£»Ę½ŗā³£ŹżK____ (ĢīŌö“ó”±”°¼õŠ” ”±»ņ”°²»±ä”±)
£Ø5£©°±Ęų»¹æÉÓĆÓŚÖʱøNCl3£¬NCl3·¢ÉśĖ®½ā²śĪļÖ®Ņ»¾ßÓŠĒæŃõ»ÆŠŌ£¬øĆĖ®½ā²śĪļÄܽ«Ļ”ŃĪĖįÖŠµÄNaClO2Ńõ»Æ³ÉClO2£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ_____________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĖłŹ¾£ØŅŅ×°ÖĆÖŠXĪŖŃōĄė×Ó½»»»Ä¤£¬¼×ĆŃµÄ½į¹¹¼ņŹ½ĪŖCH3OCH3£© 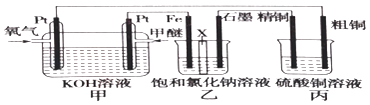
øł¾ŻŅŖĒó»Ų“šĻĀĮŠĻą¹ŲĪŹĢā£ŗ
£Ø1£©Š“³öøŗ¼«µÄµē¼«·“Ó¦£ŗ £®
£Ø2£©ĒāŃõ»ÆÄĘÖ÷ŅŖŌŚ£ØĢī”°Ģś¼«”±»ņ”°ŹÆÄ«¼«”±£©ĒųÉś³É£®
£Ø3£©Čē¹ū“ÖĶÖŠŗ¬ÓŠŠæ”¢ŅųµČŌÓÖŹ£¬Ōņ“ÖĶµÄµē¼«·“Ó¦ĪŖ£ŗ”¢ £®
£Ø4£©·“Ó¦Ņ»¶ĪŹ±¼ä£¬ĮņĖįĶČÜŅŗµÄÅØ¶Č½«£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©£®
£Ø5£©ČōŌŚ±ź×¼×“æöĻĀÓŠ2.24LŃõĘų²Ī¼Ó·“Ó¦£¬±ū×°ÖĆÖŠŅõ¼«Īö³öĶµÄÖŹĮæĪŖ £®
£Ø6£©Čō½«±ū×°ÖĆøijÉŌŚ±ź×¼×“æöĻĀ£¬ÓĆŹÆÄ«×÷µē¼«µē½āĢå»żĪŖ2LµÄCuSO4ČÜŅŗ£¬Š“³öµē½āCuSO4ČÜŅŗŹ±µÄĄė×Ó·“Ó¦·½³ĢŹ½£»µ±µē½āŹŹµ±Ź±¼äŗó¶ĻæŖµēŌ“£¬·¢ĻÖÖ»Šč²¹³ä22.2g¹ĢĢåCu2£ØOH£©2CO3¼“æÉŹ¹µē½āŅŗ»Öø“µ½ŌÅضČÓėĢå»ż£¬ŌņŌCuSO4ČÜŅŗµÄÅØ¶ČŹĒmol/L£»Čō½«±ūÉč¼Ę³ÉŌŚ¶Ę¼žÉĻ¶ĘĶµÄ×°ÖĆ£¬øĆČēŗĪøĶƣ¬ĒėÓĆ¼ņŅŖµÄÓļŃŌŠšŹö£ŗ £®
£Ø7£©Čō½«ŅŅÖŠµÄ½»»»Ä¤Č„µō£¬·¢ĻÖÖ»ÓŠH2ŅŻ³ö£¬ŌņŹŌŠ“³öŅŅ³ŲÖŠ·¢ÉśµÄ×Ü·“Ó¦£ŗ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij¶ĢÖÜĘŚŌŖĖŲ×īĶā²ćÖ»ÓŠ2øöµē×Ó£¬ŌņøĆŌŖĖŲŅ»¶ØŹĒ
A.µŚ1”¢2»ņ3ÖÜĘŚŌŖĖŲB.×īøßÕż¼ŪĪŖ+2
C.IIA×åŌŖĖŲD.½šŹōŌŖĖŲ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻŌŖĖŲÖÜĘŚ±ķŗĶŌŖĖŲÖÜĘŚĀÉ£¬ÅŠ¶ĻĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ

A. ĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌ£ŗH2O£¾NH3£¾SiH4
B. ĒāŌŖĖŲÓėĘäĖūŌŖĖŲæÉŠĪ³É¹²¼Ū»ÆŗĻĪļ»ņĄė×Ó»ÆŗĻĪļ
C. ÉĻĶ¼ĖłŹ¾ŹµŃéæÉÖ¤Ć÷ŌŖĖŲµÄ·Ē½šŹōŠŌ£ŗCl£¾C£¾Si
D. ÓĆÖŠĪÄ”°![]() ”±£Øؤo£©ĆüĆūµÄµŚ118ŗÅŌŖĖŲŌŚÖÜĘŚ±ķÖŠĪ»ÓŚµŚĘßÖÜĘŚ0×å
”±£Øؤo£©ĆüĆūµÄµŚ118ŗÅŌŖĖŲŌŚÖÜĘŚ±ķÖŠĪ»ÓŚµŚĘßÖÜĘŚ0×å
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪļÖŹAµÄ½į¹¹¼ņŹ½ĪŖCH3”ŖCH=CH”ŖCH2OH”£ĻÖÓŠ ¢ŁĀČ»ÆĒā”¢¢ŚäåĖ®”¢¢Ū“æ¼īČÜŅŗ”¢¢Ü2”Ŗ¶”Ėį”¢¢ŻĒāŃõ»ÆÄĘČÜŅŗ£¬ŹŌøł¾ŻAµÄ½į¹¹ĢŲµć£¬ÅŠ¶ĻŌŚŅ»¶ØĢõ¼žĻĀ£¬ÄÜÓėA·“Ó¦µÄĪļÖŹŹĒ
A.¢Ł¢Ś¢ÜB.¢Ś¢Ū¢ÜC.¢Ł¢Ś¢Ü¢ŻD.¢Ś¢Ü¢Ż
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com