
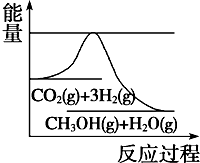
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实 验 组 |
温 度 /℃ |
起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
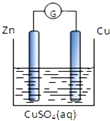
| A、不能形成原电池 |
| B、能形成原电池,Zn为负极,发生氧化反应 |
| C、能形成原电池,Zn为正极,发生氧化反应 |
| D、以上说法都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| B、某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| C、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同 |
| D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)<c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H2)?c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
| ③ |
| A、石油主要是由烃组成的混合物 |
| B、①主要发生物理变化 |
| C、②包括裂化、裂解等过程 |
| D、③是加成反应,产物名称是溴乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com