
| A.F2和Br2的沸点 | B.H—和H+的离子半径 |
| C.同温下同压分别在1升水中最多能溶解的Cl2和SO2的体积 | |
| D.在NH3+NO → N2+H2O反应中,被氧化和被还原的N原子数 |
科目:高中化学 来源:不详 题型:计算题
| 编号 | 1 | 2 | 3 |
| 混合物质量/g | 4.36 | 5.54 | 9.81 |
| 硫酸溶液体积/mL | 50.00 | 50.00 | 50.00 |
| 生成SO2的物质的量/mol | 0.03 | 0.0375 | 0.03 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某物质只含有一种元素,则该物质可能为混合物 |
| B.16O与18O互为同位素,且核外电子排布方式相同 |
| C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同 |
| D.氧化还原反应中,一种元素化合价上升,一定有另一种元素化合价下降 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
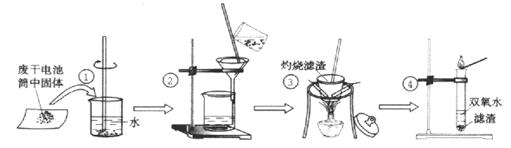
 其空白处的内容:
其空白处的内容:| 实验目的 | 操作 | 实验现象 | 结论 |
| 1、检验Cl— | 取少许滤液于试管中, | | 含有Cl— |
| 2、检验NH4+ | 取少许滤液于试管中, | | 含有NH4+ |
| 3、检验Zn2+ | 取少许滤液于试管中,加入 稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe3O4 ,Fe2O3
Fe3O4 ,Fe2O3 Fe 可知,欲实现I反应过程应从___________ (填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从 中找物质。
Fe 可知,欲实现I反应过程应从___________ (填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从 中找物质。 下面对应的横线上,组成一个配平了的化学方程式,并标出电子转移的方向和数目。(提示:反应物是Fe2O3和3 CO )
下面对应的横线上,组成一个配平了的化学方程式,并标出电子转移的方向和数目。(提示:反应物是Fe2O3和3 CO )


 + ="==== " +
+ ="==== " +  4NO+6H2O,则根据质量守恒定律可以推出X的化学式为 。
4NO+6H2O,则根据质量守恒定律可以推出X的化学式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeO42-是还原产物 | B.ClO-是还原剂 |
| C.1molFe(OH)3得到3mol电子 | D.配平后OH- 的化学计量数为4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com