
 某兴趣小组利用如图所示装置进行实验,对钢铁的电化学腐蚀原理进行探究.
某兴趣小组利用如图所示装置进行实验,对钢铁的电化学腐蚀原理进行探究.

科目:高中化学 来源: 题型:
| A、Na+ K+ HCO3- Cl- |
| B、NH4+ Mg2+ SO42- Cl- |
| C、K+ Na+ SO42- SiO32- |
| D、K+ Na+ OH- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③①④② | B、①②③④ |
| C、③②①④ | D、①④③② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化钠溶于水中:S2-+2H2O?H2S+2OH- |
| B、醋酸溶解鸡蛋壳:2CH3COOH+CaCO3=Ca2++2CH3COO-+CO2↑+H2O |
| C、NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ |
| D、NH4HCO3溶液与足量的NaOH溶液反应:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠可用于治疗胃酸过多 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 将Na2O2投入水中充分反应后,滴入酚酞变红 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发生透雾性强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | 保存NaOH溶液的试剂瓶用橡皮塞 | NaOH能与玻璃中的SiO2发生反应 | Ⅰ对,Ⅱ对,有 |
| A、A、 | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
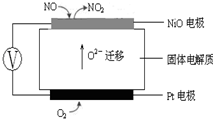 (1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:6Ag(s)+O3(g)=3Ag2O(s)△H1
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:6Ag(s)+O3(g)=3Ag2O(s)△H1| 催化剂 |
| 投料比[n(NO2)/n(CH4)] | 400K | 500K | 600K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:
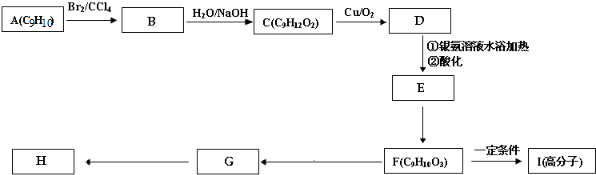
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com